Hledání mezí darwinizmu
Michael J. Behe
The Edge of Evolution, první vydání: 2007, USA. Překlad M. T. od 11/2008)
Obsah:

Hledání mezí evoluce
1. Základy darwinizmu
2. Závody ve zbrojení či zákopová válka?
3. Matematické meze darwinizmu
4. Co darwinizmus zvládne
5. Co darwinizmus nezvládne
6. Výstupní hodnoty
7. Pravidlo dvou vazných míst
8. Námitky vůči hranici
9. Katedrála a obloukové výplně (spandrely)
10. Celý svět jako jeviště
Dodatek A: Já, nanobot
Dodatek B: Odolnost vůči antimalarikům
Dodatek C: Skládání bakteriálního bičíku
Dodatek D: Falešný hráč
Poznámky
Poděkování
Rejstřík
MICHAEL J. BEHE (na úvodní fotografii) získal titul profesora biologických věd na univerzitě Lehigh (Pensylvánie, USA), kde pracoval od roku 1985. Od roku 1978 do roku 1982 pracoval na postdoktrorské práci v oblasti struktury DNA v Národním Institutu Zdraví.
Od roku 1982 do roku 1985 byl asistujícím profesorem chemie na Královské vysoké škole v New Yorku. Je autorem více jak 40 odborných pojednání, ale nejvíce je znám jako autor knihy „Darwinova černá skříňka: biochemická výzva evoluční teorii“. Bydlí ve městě Bethlehem v Pensylvánii, se svou ženou a devíti dětmi.
1. Kapitola: Základy darwinizmu
Život na Zemi se vyvíjel po miliardy let pouhou náhodou, filtrován přírodním výběrem. Tak praví darwinizmus, nejvlivnější myšlenka naší doby. Pokud vzácná náhodná mutace v DNA jistého tvora v dávné minulosti pomohla šťastnému mutantu zplodit více potomstva než jiní tvorové jeho druhu, pak se prý s postupem generací změnil druh jako celek. Neustálé opakování tohoto jednoduchého procesu po celé věky vytvořilo od základu zázraky biologie, od složitého molekulárního ústrojí buněk až k lidské mysli a včetně ní.
Tak to alespoň někteří vědci tvrdí. Ale je tomu tak? Abychom na tuto otázku odpověděli, musíme Darwinovu teorii pečlivě prověřit, protože nejde pouze o jedinou myšlenku – jde vlastně o směs několika neprovázaných, zcela samostatných myšlenek. Tři nejdůležitější z nich, jimiž teorie začíná, jsou náhodná mutace, přírodní výběr a vývoj ze společného předka.
Vývoj ze společného předka je to, co si většina lidí představí, slyší-li slovo „evoluce“. Jde o tvrzení, že různé druhy moderních tvorů mohou vystopovat svůj původ až ke společnému předku. Například o pískomilech a žirafách – dvou savcích – se soudí, že oba jsou potomky jediného tvora z daleké minulosti. A tak tomu je i s organizmy z mnohem vzdálenějších čeledí – buvoly a káňaty, prasaty a petúniemi, jaky a droždím.
To je určitě zarážející, takže je pochopitelné, že někteří lidé považují myšlenku vývoje ze společného předka za natolik překvapivou, že už dále záležitost nezkoumají. Avšak se značnou nadsázkou je vysvětlení vývoje ze společného předka také triviální. Postulování společného předka se snaží vysvětlit pouze podobnosti mezi tvory. Říká pouze to, že jisté sdílené rysy zde byly od počátku – měl je právě tento předek. V podstatě se však nepokouší vysvětlit, jak tyto rysy či onen předek vůbec vznikli či proč se potomci liší. Například jak králíci tak medvědi mají srst, takže myšlenka vývoje pouze konstatuje, že jejich předek měl srst také. Jak rostliny tak zvířata mají složité buňky s jádry, takže musely zdědit tento rys od společného předka. Avšak otázky jak nebo proč zůstávají nezodpovězeny.
Na rozdíl od toho je Darwinův předpokládaný mechanizmus evoluce – složitá myšlenka náhodných mutací spojených s přírodním výběrem – rozhodně ambicióznější. Spojení náhodných mutací a přírodního výběru se pokouší vysvětlit rozdíly mezi tvory. Snaží se odpovědět na klíčovou otázku: Co mohlo způsobit takové šokující změny? Jak se z jednoho druhu původního zvířete mohli časem vyvinout tak různí tvorové jako jsou řekněme netopýři a velryby?
Analyzujme nyní tuhle složitou myšlenku. Nejprve vezměme přírodní výběr. Podobně jako myšlenka vývoje ze společného předka je přírodní výběr myšlenkou zajímavou, ale vlastně docela skromnou. Sama o sobě říká idea přírodního výběru prostě to, že schopnější zástupci druhu zplodí lépe přežívající potomstvo než méně schopní. Takže kdyby celkový počet jedinců určitého druhu zůstával stejný, nahradilo by časem potomstvo schopnějších potomky méně schopných. Sotva asi překvapí, že tvorové, kteří jsou v určitém ohledu schopnější (silnější, rychlejší, pilnější) si v přírodě povedou v zásadě lépe než ti, kteří byli méně schopní (slabší, pomalejší, křehčí).
Zdaleka nejproblematičtějším aspektem Darwinovy mnohostranné teorie je úloha náhodné mutace. Téměř vše, co je průlomové a důležité v Darwinově myšlení, je soustředěno v tomto třetím pojmu. Darwin měl za to, že jediný způsob, jak se rostlina či zvíře stane schopnějším než jejich příbuzní, je to, že u nich proběhne výjimečně šťastná mutace. Pokud tato mutace učiní organizmus silnějším, rychlejším, či v nějakém ohledu pilnějším, pak se od této chvíle může ujmout role přírodní výběr a pomoci zajistit, aby měl takový organizmus početné potomstvo. Ale než dojde k náhodné mutaci, může přírodní výběr jen nečinně vyčkávat.
Náhodná mutace, přírodní výběr, společný předek – tři rozdílné myšlenky přetavené do jediné teorie. Jelikož zde byly smíšeny různé pojmy, má otázka, zda je darwinizmus pravdivý, několik možných odpovědí. Jednou z možností samozřejmě je to, že by tyhle rozdílné pojmy – společný předek, přírodní výběr a náhodná mutace – mohly všechny být zcela správné a postačovat k vysvětlení evoluce. Nebo by všechny mohly být správné v tom ohledu, že k náhodné mutaci a přírodnímu výběru dochází, ale mohly by být bezvýznamné v argumentaci, neschopné vysvětlit většinu evoluce. Je také možné, že jedna myšlenka by mohla být zcela správná, zatímco ostatní by byly úplně chybné. Nebo by jedna mohla být správná větší měrou, zatímco jiná by obstála měrou mnohem menší. Protože se jedná o samostatné koncepty, musíme důkazy pro každý aspekt Darwinovy teorie hodnotit nezávisle. Předchozí generace vědců je pohotově rozlišovaly. Mnoho vůdčích biologů konce devatenáctého a začátku dvacátého století mělo za to, že původ ze společného předka je myšlenkou správnou, kdežto náhodná mutace/přírodní výběr jsou chybné.
Za uplynulých sto let došlo ve vědě k obrovskému pokroku; o čem svědčí výsledky moderní vědy? Stručně řečeno, důkazy pro původ ze společného předka se zdají nezvratné. Výsledky moderních experimentů se sekvenováním DNA (o nichž se vědcům z devatenáctého století jako byl Charles Darwin ani nezdálo) ukazují, že některé vzdáleně příbuzné organizmy sdílejí zdánlivě nahodilé rysy svých genů, což zdá se nemá jiné vysvětlení než fakt, že je zdědily po vzdáleném společném předku /Poz. editora: jiné vysvětlení je, že tyto sekvence Stvořitel použil jako aplikovatelné a vhodné pro danou vlastnost či funkci u obou vzdálených organizmů/. Za druhé, existují též přesvědčivé důkazy o tom, že náhodná mutace spojená s přírodním výběrem může zásadním způsobem ovlivnit život. Avšak za třetí, existují pádné důkazy toho, že náhodná mutace je nesmírně vzácná. Nyní, kdy známe sekvence mnoha genomů, nyní, kdy víme, jak k mutacím dochází i to, jak často se objevují, můžeme zkoumat možnosti a limity náhodné mutace s určitou mírou přesnosti – poprvé od doby, kdy Darwin přišel se svou teorií.
Jak uvidíme v téhle knize, genetické náhody mohou způsobit evoluční změny do určité míry, ale jen do určité míry. Jak se shodovaly dřívější generace vědců, najít důkazy pro zásadní roli náhodných mutací je extrémně obtížné – kromě výjimek v okrajových částech života. Pro spoustu důvodů majících málo společného s vědou je tenhle hlavní aspekt Darwinovy teorie – síla přírodního výběru spojená s náhodnou mutací – předkládán moderní veřejnosti v přehnané míře jako hotový fakt.
V poslední době prosazují Darwinovi intelektuální následovníci agresivně svou myšlenku na veřejnosti jako určitý druh biologické teorie všeho. Tvrdí, že uplatnění Darwinových zásad v lékařství nám objasní, proč občas onemocníme. Darwinovská psychologie vysvětluje, proč někteří muži znásilňují ženy a proč některé ženy zabíjejí svá novorozeňata. Sklon posuzovat svět Darwinovými brýlemi se prosadil v humanitních vědách, právu i politice. Vinou rétorického mlžení, které obklopuje diskuse o evoluci, je pro veřejnost těžké rozhodovat o tom, co je solidní a co je iluzorní. Avšak jsou-li nabubřelá tvrzení darwinizmu pouhým chvástáním, pak je společnost vedena zcela na scestí co se týče záležitostí – sahajících od původu nemocí po trestnost zločinců – , jež mohou mít vážné důsledky pokud jde o praktický život.
Darwinizmus je coby teorie všeho často předkládán jako volba „vše anebo nic“. Buď přijmi celou teorii nebo se rozhodni pro to, že evoluce je pouhou spekulací a vylij s vaničkou i dítě. Oba přístupy jsou scestné. Když se budeme vyrovnávat s častými hrozbami přírody, nemůžeme si dovolit ten luxus, že dáme přednost něčím lichým dogmatům před daty. Účelem této knihy je proniknout mlhou, nabídnout střízlivé zhodnocení toho, čeho jsou darwinovské procesy schopny a čeho nikoli, nalézat to, čemu říkám nepřekonatelná hranice evoluce.
DŮLEŽITOST CESTY
Při povrchním pohledu je Darwinova teorie evoluce lákavě prostá a na rozdíl od mnoha fyzikálních či chemických teorií ji můžeme stručně shrnout bez užití matematických vzorců: U každého druhu se objevují variace. Například jedno zvíře může být větší než jeho bratři a sestry, jiné může být rychlejší, jiné má opět světlejší srst. Bohužel ne všechna narozená zvířata se dožijí reprodukčního věku, protože není dost potravy, jež by vystačila pro všechny, a mnoho druhů má též své predátory. Takže organizmus, jemuž náhodná změna (variace) dává výhodu v boji o přežití, bude žít déle, bude se mu dařit a zanechá potomstvo. A zdědí-li užitečnou variaci po mámě a tátovi i děti, pak i ony budou mít větší šanci zanechat více potomků. Časem pak ovládnou potomci tvora s onou původní šťastnou mutací celou populaci, takže druh jako celek se změní. A zopakuje-li se takový scénář znovu a znovu, pak se druh postupně změní v cosi zcela odlišného.
Na první pohled zde není o čem diskutovat. Zdá se, že vše, co evoluce vyžaduje, je variace, výběr a dědění (jinými slovy, náhodná mutace, přírodní výběr a společný předek). A opravdu, je-li evoluční příběh formulován tak abstraktně jako v minulém odstavci, pak se darwinovská evoluce jeví jako téměř logicky nutná. Jak často tvrdí darwinovští komentátoři, musí to prostě být pravda. Existují-li ve skupině organizmů variace, a ovlivňují-li tyto variace příznivě naděje na přežití, a je-li tento rys děděn, pak je téměř jisté, že příští generace bude mít více jedinců s oním příznivým rysem. A další generace po ní jich bude mít ještě víc, a další ještě, až budou mít onen rys všichni členové druhu. Kdekoli jsou splněny tyhle podmínky, kdekoli existují variace, výběr a dědění, tam všude musí s jistotou docházet k evoluci.
Potud je vše v pořádku. Avšak abstraktní, naivní logika ignoruje velkou část skládanky. Ve skutečném světě mohou být náhodná mutace, přírodní výběr i společný předek všechny zcela pravdivé, a přece nemusí být darwinovské procesy adekvátním vysvětlením života. Aby vytvořil onu spoustu složitých struktur života, musel by darwinovský proces učinit četné souvislé kroky, muselo by dojít k celé sérii přínosných mutací, které důsledně staví jedna na druhé, aby to vedlo ke komplexnímu výsledku. Aby se to v reálném životě podařilo a nezůstávalo to pouze v naší představivosti, musí existovat biologická cesta ke struktuře, která by měla rozumnou naději na úspěch v přírodě. Jinými slovy, variace, výběr a dědičnost budou fungovat pouze tehdy, bude-li zde též hladká evoluční cesta vedoucí z biologického bodu A do biologického bodu B.
Otázka cesty je stejně zásadní v evoluci jako ve všedním životě. V každodenním životě, kdybyste měli projít poslepu z bodu A do bodu B, záleželo by velice na tom, kde by se A a B nacházely a co by leželo mezi nimi. Předpokládejme, že byste museli projít se zavázanýma očima (a, abychom onen příklad přiblížili duchu darwinizmu, zpití do němoty) z bodu A do bodu B, abyste získali nějakou odměnu – řekněme hrnec zlata. A navíc, předpokládejme, že ve své slepé omámenosti byste mohli při své cestě myslet jen na jediné – lézt stále výše kdekoli to jen lze (to napodobuje přírodní výběr, který soustavně žene druh k vyšším úrovním přizpůsobenosti). Na jedné straně, kdybyste prostě museli vylézt po jednoduchém uzavřeném schodišti vzhůru, abyste dostali onen hrnec zlata, nečinilo by to snad takový problém. Na druhé straně, kdybyste museli projít poslepu z jedné strany neznámého města na vrchol mrakodrapu na straně druhé – rušnými ulicemi, mezi překážkami, přes různá dveře – měli byste nesmírné potíže. Spíše byste nesouvisle klopýtali, šplhali po schodech na verandy, lezli po střechách aut a tak dále, vázli byste na tisíci místních vrcholů, neschopni postoupit výše, neochotni ustoupit dolů. A pokud byste prostě zkoušeli vyšplhat výše kdykoli je to možné a museli procházet poslepu a zmateně z plání u Lubbocku, Texas, na vrchol Sears Tower v Chicagu – potácejíce se zmateně rovinami, lesy, podél kaňonů, přes řeky – ani od vás ani od kohokoli z miliard dalších oslepených, zmatených lidí, kteří by snad takovou věc zkusili, by rozumný člověk neočekával, že uspějete.
V běžném životě platí, že čím větší je vzdálenost mezi body A a B a čím více je překážek v krajině mezi nimi, tím menší je naděje na úspěch cesty naslepo, i když – nebo snad právě proto – že se budeme řídit prostoduchým pravidlem jako je zásada „vždy šplhej výše; nikdy neustupuj dolů“. Totéž platí o evoluci. V Darwinově době neznali vědci mnoho podrobností o životě, takže mohli oprávněně doufat, že se ukáže, že cesty evoluce jsou krátké a hladké. Nyní však víme více. Velký pokrok moderní vědy nám ukázal, že život je nesmírně rafinovaný a složitý, zejména na základní úrovni molekuly. To znamená, že darwinovské cesty k mnoha složitým rysům života jsou docela dlouhé a hrbolaté. Problémem pro Darwina, stejně jako pro dlouhé toulání poslepu venku, zůstává tedy fakt, že v evoluční krajině plné překážek by náhodné mutace i přírodní výběr měly spíše tendenci nechávat druh padat do genetických slepých uliček, ulpívat na vrcholcích malých anatomických vršků či putovat bez cíle fyziologickými pláněmi a nikdy se nepřiblížit výhře biologického hrnce zlata na vzdáleném biologickém vrcholu. Je-li tomu tak, pak by náhodné mutace/přírodní výběr byly v zásadě neúčinné. A vskutku, námaha spojená s výstupem na kterýkoli místní evoluční kopeček by dojista odradila všechny opilce od hledání vrcholu vzdálené biologické hory.
Toto zjištění má zásadní význam: Neexistuje-li hladká, pozvolna stoupající, snadno nalezitelná evoluční cesta ústící v dohledné době do biologického systému, darwinovské procesy nebudou fungovat. V této knize budeme zkoumat, o jak náročný požadavek přitom jde.
KRÁTKÉ OHLÉDNUTÍ
Praktická otázka zní, jak daleko musí být biologické body A a B a jak hrbolatá cesta mezi nimi, aby náhodná mutace a přírodní výběr začaly selhávat? A jak můžeme určit, kdy je tento stav dosažen? Kde je v biologii přiměřené místo, kudy vede čára vyznačující nepřekročitelnou hranici evoluce?
Tahle kniha odpovídá na tyto otázky. Staví na výzkumu, který jsem započal před více než deseti lety knihou Darwinova černá skříňka. Tam jsem konstatoval, že nezjednodušitelně složité struktury – jako třeba některé nesmírně složité buněčné mašinérie – se nemohly vyvinout náhodnými mutacemi a přírodním výběrem. Abych pokračoval ve shora uvedené analogii, šlo o tvrzení, že slepý opilec se nemohl dostat z bodu A do bodu B, protože nemohl cestu zdolávat po malých krůčcích – musel by přeskakovat kaňony a řeky. Kniha končila konstatováním, že v základech života existují přinejmenším některé struktury, které přesahují rámec náhodných mutací.
Tento závěr rozvířil mnoho diskusí. Zvláště velké pozdvižení ve vědecké komunitě vyvolalo mé tvrzení, že ony struktury jsou inteligentně naplánovány. Mnoho lidí niterně nesouhlasí s takovou hypotézou, z celé řady důvodů. V této knize, ačkoli mé závěry jsou v podstatě tytéž, a někteří lidé budou nepochybně proti nim, věnuji podstatnou část kapitol argumentaci založené na důkazech z molekulární biologie, výzkumech genomu a – především – na zásadních dlouhodobých studiích evolučních změn u jednobuněčných organizmů, které prověřují darwinizmus, aniž by činily závěry o plánu. Čtenáři, kteří nemohou přijmout moje konečné závěry, by se přece jen mohli zamyslet nad důkazy uváděnými jako hlavní argumentace v oněch kapitolách, než se rozejdou s mými názory v závěrečných třech kapitolách knihy. Jak ukážu, matematické pravděpodobnosti ani biochemické struktury nemohou podporovat tvrzení darwinizmu o náhodných procesech, kromě okrajových oblastí evoluce. Když se však snažíme najít čáru označující hranice náhodnosti, není třeba hned předpokládat plán.
PŘEKONÁNÍ MRTVÉHO BODU
Darwinova černá skříňka se soustřeďovala pouze na demonstraci toho, že některé význačné struktury v životě jsou mimo dosah náhodné mutace a přírodního výběru. Tato kniha si klade cíle mnohem náročnější. Zaměřuji se v ní na vymezení logicky obhajitelných základních mezních linií vyznačujících nepřekonatelnou hranici evoluce – určit s určitou přesností, za jakým bodem již není pravděpodobné, že darwinovská vysvětlení jsou adekvátní, ne jen pro nějaké vymezené struktury, nýbrž pro základní znaky života. Dalo by se to srovnat s prací archeologa, jenž odkrývá starobylé město pohřbené v písku. Úkol rozhodnout, zda náhodné procesy vytvořily věci jako jsou jemné malby na stěnách městských staveb (snad působením vátého písku) je poměrně snadný. Nakonec není příliš pravděpodobné, že by elegantní malby vznikly náhodnými procesy, zejména jsou-li na nich nejen prosté geometrické vzory, nýbrž obrazy lidí či zvířat.
Jakmile však skončí vyzobávání třešniček, začíná makačka. Jsou ony postranní obrazce skutečně součástí malby nebo jde jen o šmouhy? Je hromádka kamení u vnějších hradeb stolem či jakýmsi oltářem nebo pouhou náhodnou kupkou hornin? Je pozemek blízko hradeb zbytkem obdělávaného pole? Kde leží hranice města? Kde přestává civilizace a začíná divoká příroda? Rozhodování o okrajových případech jako jsou tyhle je náročnější práce a vyvozené závěry budou nutně spekulativnější. Avšak na konci zkoumání získá archeolog mnohem jasnější obrázek o tom, kde končí město a kde dominují náhodné přírodní procesy.
V jistém smyslu to mají archeologové snadné. Ačkoli se musí zabývat účinky fyzikálních procesů na artefakty, které studují, nezajímají je obvykle příliš procesy biologické. V řešení záhady toho, kde asi leží vzdálené hranice darwinizmu, hrají samozřejmě hlavní roli výlučně biologické procesy. Náhodné mutace DNA bychom mohli přirovnat k náhodným událostem, které postihují neživé předměty. Rostliny a zvířata se však rozmnožují, kameny nikoli. Přírodní výběr pracuje se živými předměty, nikoli neživými. Darwinova teorie tvrdí, že náhodné genetické události a přírodní výběr působící celé věky povedou k výsledkům, které vůbec nepřipomínají náhodné efekty.
Život na zemi trvá miliardy let /Poz. editora: autor této knihy patří ke hnutí Inteligentního plánu, který se datováním nezabývá a mlčky přijímá časové evoluční chronologie. Na druhé straně mnoho jiných vědců, kteří se datováním zabývají a jsou stoupenci inteligentního stvoření, popírá, že život na zemi trvá miliardy let./. Během téhle doby zde žilo a umíralo obrovské množství organizmů. Darwinisté předpokládají, že po věky docházelo k lítým bojům mezi různými pokoleními, jež vedly k biologickým „závodům ve zbrojení“ – soupeření v tom, kdo se lépe vyzbrojí na biologický boj, analogie k promyšlenému závodu ve zbrojení ve dvacátém století mezi lidmi ve Spojených státech a Sovětském svazu. Možná, že výsledkem těchto biologických závodů ve zbrojení byl promyšlený mechanizmus života, daleko přesahující to, co bychom si běžně představovali jako výsledek působení náhodných procesů.
Tolik teorie. Ukázalo se však nesmírně obtížné takovou teorii přiměřeně ověřit. Moderní laboratorní studie náhodné mutace/přírodního výběru utrpěly neschopností zkoumat skutečně velká množství tvorů. Typické je, že i s heroickým úsilím nejlepších badatelů může být studována jen relativní hrstka organizmů, jen po relativně krátkou dobu, a jsou sledovány změny jen v několika vybraných rysech. Takové studie končí tím, že se sice dospěje k určitým zajímavým výsledkům, ale je většinou nemožné činit z nich obecné závěry. Ačkoli by vědci rádi uskutečnili rozsáhlejší a obsažnější studie, záběr problému je prostě příliš velký. Skoro nikde není dost zdrojů pro určitou laboratoř, aby takové studie uskutečnila.
Takže místo s definitivními laboratorními testy, v nouzi, pracuje většina biologů s darwinovskou koncepcí a prostě předpokládá to, co nemůže být prokázáno. To bohužel může vést k pochopitelnému, nicméně přece jen zhoubnému intelektuálnímu návyku přehlížení rozdílu mezi tím, co je předpokládáno, a tím, co bylo prokázáno. Rozdíly mezi diametrálně se lišícími druhy organizmů jsou automaticky připisovány náhodným mutacím a přírodnímu výběru i nejbystřejšími vědci a i ty nejelegantnější z biologických rysů jsou opakovaně vysvětlovány pomocí Darwinovy teorie.
Prolomení teoretické bariéry by vyžadovalo přesná evoluční data na genetické úrovni o obrovském množství organizmů, jež jsou pod neustálým tlakem přírodního výběru. Tato data nebyla v minulosti prostě k dispozici. Nyní jsou.
SKOKY A MEZE
Dokonce i před takovými deseti lety by byl každý pokus zjistit hranici evoluce s určitou přesností skoro nemožný. Bylo známo příliš málo. Ale díky houževnatému pokroku vědy, zejména v uplynulé dekádě, se úkol stal proveditelným.
Hlavní obtíží při hodnocení evoluční teorie jako je Darwinova je fakt, že zatímco můžeme snadno pozorovat velké změny u zvířat a rostlin, důvody těchto změn nejsou jasné. Darwin a ostatní dřívější vědci mohli zkoumat, řekněme, změny pěnkavích zobáků, ale neuměli vysvětlit, co tyto modifikace způsobuje. Blíže k dnešku, vědci z poloviny dvacátého století byli s to určit, že některé bakterie vyvinuly odolnost vůči antibiotikům, ale nevěděli přesně, co jim dalo tuto schopnost. Teprve v posledním půlstoletí věda prokázala, že viditelné změny působí mutace v neviditelných molekulách, v DNA a bílkovinách. Jedinou cestou, jak realisticky porozumět tomu, co náhodné mutace a přírodní výběr vlastně umějí, je sledovat změny na molekulární úrovni. Je zásadně důležité si zapamatovat toto: Správné zhodnocení Darwinovy teorie v každém případě vyžaduje hodnotit náhodné mutace a přírodní výběr na molekulární úrovni. Bohužel i dnes vyžaduje takový postup hodně tvrdou práci. Ale není jiné cesty.
Dobrou zprávou je, že s velkým úsilím a hlubokým porozuměním vyvinula moderní věda nástroje, jak tuto práci zvládat. Triumfem vědy dvacátého století je to, že objasnila podmínky jednoho z požadavků Darwinovy teorie – podmínky, které tvoří základnu pro variace. Víme nyní, že variace u organismů závisí na skrytých změnách v jejich DNA. (Přehled struktury DNA najdete v dodatku A). A co víc, vědci sestavili přehled nesčetných způsobů, jimiž se může DNA měnit. Nejenže se mohou náhodně měnit samotné jednotky DNA (zvané nukleotidy), když se DNA kopíruje v nové generaci, nýbrž celé velké sekvence dvoušroubovice se mohou náhodou buď zdvojit či vypadnout. Velmi vzácně se zkopíruje dvakrát veškerá DNA v buňce, což vede k potomstvu s dvojnásobnou DNA, než měli rodiče. Jindy mohou aktivní prvky DNA připomínající viry umístit své kopie do nových pozic v genomu; někdy přitom s sebou strhnou i jiné kousky DNA. Příležitosti pro přírodu ke změně DNA určitého organizmu jsou prakticky bezmezné.
Tvrdá práce mnoha vědců prokázala nejen to, na čem jsou založeny variace, nýbrž vysvětlila také celkem dobře to, na čem závisí rychlost a poměr mutací. Pravidlem přitom je, že kopírování DNA je zpravidla velmi věrné. Průměrně se stane chyba pouze jednou za každých přibližně sto milionů nukleotidů DNA kopírovaných v jedné generaci. Existují však výjimky. U některých virů jako je HIV se četnost mutací neobyčejně zvyšuje.
Další důležitý pokrok v naší schopnosti důkladně otestovat darwinizmus přineslo sekvenování DNA. V uplynulých několika dekádách množství sekvenované DNA rostlo geometrickou řadou a zvyšovalo se množství organizmů studovaných sekvenováním. V polovině 90.let byla publikována první úplná sekvence genomu určitého organizmu – nepatrné bakterie zvané Hemophilus influenzae. Nyní známe sekvence stovek genomů. Nejen sekvenování celých genomů, nýbrž snadná možnost sekvenovat alespoň klíčové partie DNA organizmu dává vědcům schopnost definovat přesně molekulární změny, které zaviňují geneticky podmíněné nemoci nebo které způsobují odolnost vůči antibiotikům.
Veškerý tento vědecký pokrok by však ještě nestačil k tomu, aby bylo možno učinit přiměřeně spolehlivé závěry o možnostech darwinovské evoluce, pokud bychom nemohli studovat dostatečné množství organizmů. Čím více organizmů máme, tím více má náhodná mutace příležitostí vytvořit přínosnou změnu a předat ji přírodnímu výběru a tím spolehlivější budou naše závěry o tom, co může darwinizmus dokázat. Studie zvířat jako jsou pěnkavy mohou přinejlepším sledovat stovky jedinců. V laboratoři lze zkoumat tisíce octomilek. To už je lepší, ale stále daleko od dostatečného počtu. V případě tisíců či dokonce milionů organizmů se mutace vyskytne relativně vzácně, a z tohoto počtu je opět jen velmi málo mutací přínosných.
Příroda se samozřejmě hemží organizmy. Na naší planetě mohou být v jednom okamžiku miliardy zástupců savčího druhu, jako třeba lidí či krys. V mořích žijí obrovská množství ryb. A to se zmiňujeme jen o větších živočiších. Existují také nesčetné organizmy mikroskopické jako jsou bakterie a viry. Zatímco laboratoře nemohou vypěstovat dostatečné množství tvorů k tomu, aby získaly dostatečný nástroj ke studiu schopností darwinovské evoluce, příroda takové problémy nemá.
Evoluce ze společného předka, přes změny v DNA, je velmi dobře doložena. Může a nemusí být náhodná. Díky evoluci nestudují vědci, kteří sekvenují lidskou DNA a nalézají mutace, které jsou přínosné – proti, řekněme, našim přirozeným nepřátelům – pouze DNA jedné osoby. Sledují vlastně výsledky boje, který probíhal po dlouhé věky a zahrnoval miliony a miliony lidí. U jednoho z předků moderního člověka se poprvé vyskytla přínosná mutace, a jeho potomci předstihli v boji o život potomky mnoha dalších lidí. Tak tedy moderní situace odráží evoluční historii zahrnující mnoho lidí. Když vědci sekvenují genom, nahlížejí do bohaté dokumentace evoluce – darwinovské či jiné – kterou neposkytne žádná jiná metoda výzkumu.
KOUŘÍCÍ PISTOLE DARWINIZMU
Díky své nesmírné populační rozloze, rychlosti rozmnožování i našim znalostem genetiky je jediným a nejlepším prubířským kamenem Darwinovy teorie historie malárie. Většina téhle knihy se bude zabývat touhle chorobou. Lidstvo postihuje mnoho parazitárních onemocnění, ale historicky největší kletbou je malárie, která je též jedním z nejdůkladněji studovaných onemocnění. Již deset tisíc let rozsévá komáry přenášený parazit nemoc a smrt ve velké části světa. Ještě před sto lety nevědělo lidstvo nic o příčině malarické horečky, takže nebyla možná žádná vědomá obrana. Jedinou cestou, jak omezit intenzívní, neustálý selektivní tlak parazita, byly účinky náhodných mutací. Stovky různých mutací umožňujících do jisté míry odolnost vůči malárii se vynořovaly v lidském genomu a šířily se naší populací cestou přírodního výběru. Tyhle mutace vydávali darwinisté za jedny z nejlepších, nejjasnějších příkladů schopností darwinovské evoluce.
A děje se tak i nadále. Ale, jak uvidíme, nyní, kdy byly objasněny změny způsobující odolnost vůči malárii na molekulární úrovni, vyprávějí tato fakta zásadně odlišný příběh, než darwinisté očekávali – příběh, který vrhá světlo na nesouvislé kličkování, které s sebou přináší „výzkum“ naslepo. Malárie nabízí jedny z nejlepších příkladů darwinovské evoluce, ale důkazy z ní plynoucí ukazují jak na to, co tato evoluce umí, tak na to, co neumí (a to je významnější) zařídit. Podobně změny v lidském genomu jako odpověď na malárii také zdůrazňují zásadní omezení účinnosti náhodných mutací.
Protože je studována tak rozsáhle i vzhledem k astronomickému počtu organizmů, které se na celé záležitosti podílejí, je evoluční bitva mezi lidmi a naším prastarým osudovým prokletím malárií nejlepší a nejspolehlivější základnou, kterou máme pro formulování úsudků o schopnostech náhodných mutací a přírodního výběru. Pár dalších zdrojů informací se tomuto primárnímu zdroji ještě přibližuje. A jak uvidíme, i oněch pár zdrojů vypráví podobné příběhy.
(Upozornění pro čtenáře: Bohužel, abychom plně pochopili a mohli zhodnotit obtíže spojené s náhodnými mutacemi i to, do jaké míry je ilustruje bitva lidstva s malárií, musíme zatnout zuby a zabývat se podrobnostmi oné bitvy na molekulární úrovni. Vynasnažím se omezit technické podrobnosti na minimum, a některé z nich jsou přesunuty do dodatků. Ale nelze se úplně vyhnout faktu, že naše látka vyžaduje technické podrobnosti.)
Ačkoli počet malarických buněk je velký, je to mnohem méně než počet organizmů, které existovaly na zemi. Nicméně, jak vysvětlím, přímé extrapolace z dat o malárii nám umožňují stanovit přijatelné hypotézy o omezeních, jež můžeme očekávat od náhodných mutací, i pro veškerý život na zemi v uplynulých několika miliardách let. Nejen to, nýbrž studie bakterie E. coli i viru HIV, který způsobuje AIDS, poskytují jasné potvrzení závěrů, k nimž docházíme studiemi malárie. Zejména HIV je čímsi jako rosettskou deskou pro studium náhodných mutací, protože takovéto viry mutují mimořádně rychle, desettisíckrát rychleji než buňky. Viry obsahují mnohem méně genetického materiálu, ten ale mutuje tak rychle a existuje tolik jeho kopií, že pouhý HIV prodělal jen za posledních padesát let více některých druhů mutací než je těch, k nimž došlo u všech buněk od počátku světa.
Největší část téhle knihy se zaměří na procesy v buňkách a molekulách, avšak v posledních dvou kapitolách zajdu dále. V nedávných letech, s tím, jak věda dělala úžasné pokroky, vyšly najevo některé podrobnosti o tom, jak probíhá na molekulární úrovni vývoj různých zvířecích tříd. V téhle souvislosti činím některé závěry ohledně omezení v používání náhodných mutací k vysvětlování charakteristických znaků zvířecího života. V kapitole závěrečné poukazuji pak na fakt, že závěry dosažené v téhle knize o náhodných procesech v biologii se dobře shodují s nedávnými výsledky z jiných vědeckých oborů jako je fyzika a kosmologie. Společně tedy objasňují úlohu náhody v přírodě jako celku.
TUŠENÍ NEPŘEKONATELNÉ HRANICE
Jednou z obtíží při psaní knihy zkoumající způsobilost Darwinovy teorie je fakt, že se někteří lidé nesprávně domnívají, že ji zavrhujeme jako takovou. Je načase, abychom se oprostili od myšlení buď anebo. Náhodná mutace je zcela přiměřeným vysvětlením určitých znaků života, nikoli však jiných. Tato kniha hledá hranice mezi náhodným a nenáhodným, které určují zároveň meze evoluce. Uvažte:
A – Na jedné straně existuje malárie. Prastará metla lidstva, v některých oblastech světa zabíjí malárie polovinu dětí před dosažením pátého roku věku. V polovině dvacátého století byly objeveny zázračné léky, které dokázaly vyléčit tuto obávanou chorobu, což vzbudilo naděje, že by mohla být dokonce zcela vymýcena. Avšak během deseti let vyvinul malarický parazit odolnost vůči lékům. Byly vyvinuty nové léky a vrženy do boje, ale jen s přechodným účinkem. Místo aby lidé vymýtili malárii, existují obavy, že malárie by mohla vymýtit lidstvo, přinejmenším v některých oblastech světa, jelikož v nedávné době počet úmrtí na tuhle chorobu dramaticky vzrostl. Lekce k zapamatování z malárie je tato: Evoluce je nemilosrdná, odbude mávnutím ruky i ty nejlepší snahy moderního lékařství.
B – Na druhé straně existuje srpkovitá anémie. Ačkoli ve Spojených státech je srpkovitá anémie pohromou v celé své hrůze, v Africe ukazuje, že na všem zlém je něco dobrého. Aby se rozvinulo onemocnění, musí dotyčný získat dvě kopie (po jedné od každého rodiče) zmutovaného genu pro anémii. Lidé, kteří mají jen jednu kopii, neonemocní, ale jsou navíc ještě odolní vůči malárii, a často přežívají tehdy, když ostatní umírají. Gen, který nese srpkovitou mutaci, se vynořil v lidské populaci v Africe asi před deseti tisíci lety. Mutace sama o sobě představuje jedinou, jednoduchou genetickou změnu – vůbec nic složitého. Avšak přestože se setkávala se srpkovitou mutací tisícinásobně delší dobu než s moderními léky, nenalezla malárie způsob, jak ji přelstít. Zatímco evoluční síla malárie hatí snahy moderního lékařství, nepatrná genetická změna v hostitelském organizmu malárii zneškodňuje.
A – Na jedné straně existuje HIV. Ztráty na lidských životech v důsledku AIDS v moderní době jsou srovnatelné se ztrátami v důsledku černé smrti ve středověku. Moderní výzkum vyvinul mnoho léků k boji proti AIDS, avšak po krátké době – měsících, někdy jen dnech – ztrácejí všechny svou účinnost. Důvodem je darwinovská evoluce. Genom HIV, viru způsobujícího AIDS, tvoří nepatrný kousíček RNA, zhruba milionkrát menší než je genom lidský. Jeho nepatrná velikost a velká rychlost replikace jakož i obrovské množství kopií viru číhající v nakažené osobě – vše dohromady z něj činí evoluční tank. Náhodné změny během replikace viru spolu se selekčním tlakem vyvíjeným léky umožňují varietám HIV odolným vůči lékům prospívat v bytostně darwinistickém procesu. Evoluce zde triumfuje nad lékařstvím.
B – Na druhé straně existuje E. coli. Jako běžný obyvatel lidského zažívacího traktu je tato bakterie oblíbeným předmětem studia v laboratořích již více než století. Její genetika a biochemie je pochopena lépe než u jakéhokoli jiného organizmu. V uplynulém desetiletí je předmětem nejrozsáhlejšího laboratorního studia evoluce, které kdy bylo podniknuto. Bacil se zdvojnásobuje asi sedmkrát denně a již ho bylo vypěstováno ve zkumavkách přes třicet tisíc generací. To je v tomto případě rovno asi milionu let lidských. A co s ním evoluce udělala?
Většinou devolvoval, tedy zdegeneroval. Ačkoli se změnily některé okrajové podrobnosti některých systémů, během oněch třiceti tisíc generací bakterie opakovaně odhazovala kusy své dědičné informace včetně schopnosti vytvářet některé ze stavebních kamenů RNA. Odhazováním složité, avšak nákladné molekulární mašinérie, šetří zřejmě bakterie energii. Nebylo tak vytvořeno nic byť jen vzdáleně podobné elegantní struktuře. Poučení z E. coli zní, že pro evoluci je snazší věci ničit než tvořit.
A – Na jedné straně existují nototenoidní ryby (čeleď ledovkovité) v oblasti Antarktidy, které mohou přežít teploty, které by měly zmrazit jejich krev do pevného skupenství. Studie prokázaly, že v uplynulých deseti milionech let daly nepatrné, přínosné změny v DNA ledovek těmto rybám schopnost vytvořit si zvláštní nový druh mrazuvzdornosti – nemrznoucí částečky, jež ulpí na zárodečných krystalech ledu a zastaví jejich růst. Triumf přírodního výběru.
/Krev ledovek a jim příbuzných rohaček, lupiček a ledařek obsahuje glykoprotein, který snižuje teplotu mrznutí krve. Někteří zástupci mají čirou krev, poněvadž jim zcela chybějí červené krvinky a krevní barvivo hemoglobin. Pozn. překl./.
B – Na druhé straně tu je (opět) malárie. Nelítostný malarický parazit – totéž evoluční dynamo, které se lehce vypořádá s lidskými léky – má však Achillovu patu: Nevyvine se ve svém komářím hostiteli, pokud nejsou teploty přinejmenším velmi příjemné, takže je omezen hlavně na tropy. Pokud by se parazit mohl vyvíjet za teplot nižších, mohl by se rozšířit dále. Ale navzdory desetitisícům let a obrovské populaci, mnohem větší než je populace antarktických ryb, neučinil tak. Proč mohou ryby vyvinout způsob, jak přežívat v mrazu, zatímco malárie není schopna žít i jen v poněkud chladnějších teplotách?
Kdesi uprostřed takových příkladů leží nepřekonatelná hranice evoluce.
2. Kapitola: Závody ve zbrojení či zákopová válka?
Nikoli náhodou se malárii říká „smrt kosící milióny“ (1). Každým rokem zabíjí tohle množství lidí – většinou dětí – a způsobí potíže ještě stonásobně většímu počtu lidí. Lidský genom a genom malárie se spolu potýkají již mnoho tisíc let. Po léta si jdou po krku miliardy lidí a závratné počty malarických parazitů. V tomto nelítostném, vytrvalém evolučním zápase je zvýhodněna přírodním výběrem a rozšířena do populace každá mutace, která dala jednomu z aktérů výhodu nad druhým. Díky technikám jako je sekvenování DNA byly objasněny mnohé z těchto molekulárních evolučních změn jak u lidí tak u malárie. Mnohem lépe než galapážské pěnkavy, půvabné můry drsnokřídlece březového či jiné, přitažlivější příklady přitahující imaginaci veřejnosti, nabízí malárie naše nejlepší příklady darwinovské evoluce v akci.
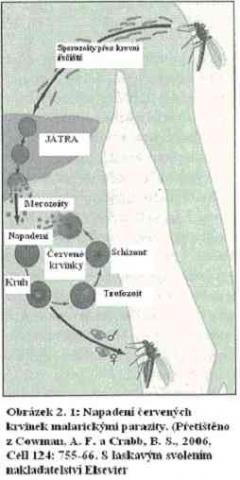
Jako nějaký mikroskopický Drákula se ďábelský malarický parazit živí naší krví. Jednobuněčný organizmus přenášený komáry vstupuje do krevního řečiště, když nás komár kousne. Jakmile jsou jednou uvnitř, obíhají malarické buňky v krvi, až se dostanou do jater, kde se chvíli zastaví, aby se pomnožily. Když je zpět v krevním oběhu, zachytí se malarická buňka na povrchu lidské červené krvinky, nalepí se pevně na ni, vplíží se dovnitř, schová se do ochranného obalu, a pak se začne živit hemoglobinem. Napadená krvinka může uváznout v našich žilách a přestat obíhat. Zatím se malárie uvnitř rozmnoží na asi dvacet kopií. Skupina nových malarických buněk pak vystřelí z (nyní zničené) červené krvinky, vrátí se do krevního řečiště, připevní se na jiné červené krvinky, a celý proces začne znovu. Jelikož se množí exponenciálně, vyrobí se v příštím kole čtyřista malarických buněk. V několika dnech se tak může vyprodukovat bilión nových malarických buněk, které pohltí značnou část krve oběti.
sporozoit = vývojová infekční fáze některých parazitujících prvoků, vznikající sporogonií. U plasmodií se uvolňují z oocysty a z trávicího traktu a slinami se přenášejí na dalšího hostitele při sání komára. (Pozn.překl.)
merozoit = nepohlavně vzniklé stadium vývoje některých prvoků. Merozoity vznikají rozpadem schizontu při schizogonii (exoerytrocytární i erytrocytární) plasmodií a napadají erytrocyty. Část z nich se vyvíjí v pohlavně diferencované gametocyty – makrogamety a mikrogamety (které hynou, nejsou-li nasáty komárem umožňujícím sexuální etapu vývoje). (Pozn.překl.)
trofozoit = vegetativní forma prvoků (Pozn. překl.)
schizont (meront) = mnohojaderná forma vznikající během asexuálního vývoje některých prvoků (schizogonie), rozpadá se v merozoity. (Pozn. překl.)
Po staletí zkoušel lidský genom mnoho různých obran proti malárii. Ve světle moderní vědy nyní rozumíme mnoha podrobnostem o každé z těchto obran – nejen jejímu genetickému plánu, nýbrž často i jejímu zeměpisnému umístění (kde na zemi se objevila) i jejímu úspěchu, s nímž se šířila lidskou populací. Poučení z těchto studií je zásadní a neočekávané:
1) darwinovské procesy jsou nespojité a velmi omezené; a
2) bitva dravce a kořisti (neboli parazita a hostitele), kterou často líčili darwinističtí pisatelé jako produktivní cyklus zlepšování na obou stranách připomínající závody ve zbrojení, je ve skutečnosti cyklem destruktivním, spíše něčím jako zákopovou válkou, kde se podmínky horší. Změny v genomu malárie jsou ještě poučnější, prostě proto, že se jich účastní tolik parazitů. Je z nich patrné toto:
3) Jako klopýtající, oslepený opilec, který padá po jednom či dvou krocích, je-li třeba více než jeden nepatrný krok pro evoluční zlepšení – je velmi nepravděpodobné, že slepá náhodná mutace tento krok učiní. A
4) extrapolace z dat o nesmírném množství malarických parazitů nám umožňuje zhruba ale spolehlivě odhadnout meze darwinovské evoluce pro veškerý život na zemi za posledních několik miliard let.
SABOTÁŽE
Buňky jsou roboti. Nebo spíše, protože jsou tak malé, „nanoboti“. Pracují nevědomými, automatickými mechanizmy. Aby zvládly rutinní úkoly svých mikroskopických životů, potřebují buněční nanoboti složité molekulární soustrojí, které pracuje bez vědomého řízení. Aby se mohla nalepit na červené krvinky, napadnout je, živit se jimi a zvládat další základní úkoly, má malárie všechna možná složitá molekulární hejblata a čudlíky. A má je i červená krvinka, pro všechny své každodenní úkoly.
Automatizované soustrojí může být samozřejmě docela křehké. Složitý mechanizmus může být zastaven prostě trochou písku ve svých soukolích či jinou dobře připravenou sabotáží. Navigační soustava robota může být zablokována, chybí-li očekávané orientační body. Automatizované soustrojí může fungovat velmi dobře v jistých mezích, ale může snadno selhat vně svých provozních specifikací.
Kdykoli na sebe musí působit dva oddělené, automatické mechanizmy, je zde mnoho příležitostí k tomu, aby se něco zadrhlo. Nakažení osoby malárií může být znázorněno jako napadení automatizovaného města armádou robotů. I když myslící lidé umějí improvizovat, stroje to neumějí. Je-li robotizovaná armáda naprogramována řekněme k tomu, aby přešla určitý most, invazní cesta může být zablokována tak, že tento most spálíme. Má-li útočící robot klíč k jisté budově ve městě, může být zastaven tak, že zdeformujeme zámek oné budovy, aby se k ní klíč již nehodil. Na molekulární úrovni se lidská odolnost vůči malárii velmi podobá těmto destruktivním příkladům.
Život malarické buňky v lidském těle je dosti složitý. Reaguje s mnoha lidskými strukturami a systémy (játra, červené krvinky, cévní stěny, pokožka, svalstvo, imunitní systém a jiné) a musí zvládat mnoho úkolů (pouť z místa komářího bodnutí do jater, rozpoznání jater, pomnožení se v játrech, navázání se na červenou krvinku a tak dále), aby se malarická buňka úspěšně připravila na opětovné nasátí v budoucí krvavé hostině hladového komára. To znamená, že parazitární nanobot má mnoho zranitelných míst, kde může dobře mířená sabotáž způsobit, že se invaze pomalu se skřípěním zastaví.
Evoluční tlak na lidstvo, aby přišlo s nějakou mutační sabotáží k boji proti malárii, je zhruba tak intenzívní, jak jen může být. Kdyby byla malárie mnohem smrtelnější nebo nakažlivější než je, neexistovalo by tu už žádné lidstvo, kterému by dělala těžkou hlavu. Každý člověk, který by se narodil v malarické oblasti země s nějakou genetickou změnou – takovou, která by řekněme pálila molekulární mosty – , která by ho činila odolným vůči parazitovi, by mohl mít děti, které by zdědily jeho imunitu. Jeho děti by přežívaly tam, kde by mnoho dalších dětí ve vesnici hynulo na tuto chorobu. Až by jeho děti dorostly, tvořily by větší část populace vesnice, prostě proto, že choroba by vyvraždila jiné děti, které nemají šťastnou genetickou změnu. Časem by potomci oné šťastné ženy překonali co do počtu potomky kohokoli jiného. Nakonec by každý člověk ve vesnici měl mutaci vyvolávající odolnost. Evoluce cestou náhodné mutace a přírodního výběru by změnila svět, přinejmenším v tomto jednom ohledu.
Ukazuje se, že shora popsaný scénář se odehrál v průběhu historie lidstva několiksetkrát. Důmyslný lidský genom „vymyslel“ spoustu různých způsobů, jak překazit zlé úmysly prvoka Plasmodium falciparum (nejvirulentnější druh malárie). V téhle kapitole probereme několik evolučních odpovědí lidí na malárii, které dokazují, že nepřekonatelná hranice evoluce je skutečně mnohem dál, než se nalézají odpovědi lidského těla na parazity. Znovu a znovu se setkáme s případy, kdy je evoluce destruktivní, nikoli konstruktivní. Převažujícím poučením z téhle kapitoly je, že metafora tak milovaná darwinisty – totiž že evoluce jsou závody ve zbrojení – je chybná. Evoluce je zákopovou válkou. Začněme tím, že si posvítíme na to, jak jedna dobře známá antimalarická sabotáž vyřadí z normální činnosti také červené krvinky.
UBÍJENI SRPKEM
Přátelská, příjemná mladá žena, Gail C., chodívala do mé laboratoře zhruba každých čtrnáct dní, když jsem postgraduálně studoval biochemii na univerzitě v Pennsylvanii uprostřed 70. let 20. století. Někdy ji doprovázívala také maminka, aby jí pomáhala při chůzi. Gail přistupovala pomalu a toporně ke stolu v laboratoři a posadila se. Vytáhl jsem dvě malé zkumavky krve z žíly na její paži a zaplatil jí deset dolarů (z peněz z grantu svého výzkumného poradce). Namáhavě pak vstala a odcházela. Vzal jsem kapku její krve a podrobil hemoglobin standardní laboratorní proceduře, při níž elektrické pole protlačí bílkovinu polotuhým gelem. Vedle Gailiny krve jsem použil i kapku své vlastní. Její hemoglobin se pohyboval gelem jaksi pomaleji než můj – pomaleji než by se pohyboval u většiny Američanů – protože Gail měla srpkovitou anémii. Nevím, co se stalo s Gail po letech, ale většina lidí se srpkovitou anémií umírá mladá. Trpí velkými bolestmi ve svém zkráceném životě, všechno proto, že jejich hemoglobin má ve své struktuře nešťastnou změnu.
Hemoglobin byl jednou z prvních bílkovin studovaných vědci v moderní době, jelikož ho lze snadno získat (krev je ho plná) a je dobře viditelný (většina bílkovin je bezbarvá, avšak hemoglobin je jasně rudý a je zabalen do červených krvinek). Hemoglobin je bílkovina, jejímž úkolem je přenášet kyslík. Přenášet kyslík není snadné – velmi málo bílkovin to umí. Hemoglobin je však profík. Nejenže sbírá kyslík tak, že se na něj pevně naváže v plících, ale také uvolňuje kyslík v okrajových tkáních, kde je ho třeba. Ačkoli se to snadno popisuje, vyžaduje tato malá procedůra velmi přesné technické řešení tvaru a sledu aminokyselin u hemoglobinu. Je známo mnoho geneticky podmíněných nemocí, kdy jediná změna aminokyseliny zničí schopnost hemoglobinu účinně přenášet kyslík.
V případě hemoglobinu srpkovité anemie se jediná aminokyselina liší od hemoglobinu normálního. Hemoglobin má dvě kopie každého ze dvou různých druhů řetězců aminokyselin. Tyhle čtyři řetězce, dva „alfa“ a dva „beta“, zapadají přesně jeden do druhého, aby mohly vykonávat svou práci. V řetězci beta, na pozici číslo 6 ze 146 aminokyselin, způsobuje potíže jediná změna. Tahle jediná změna je buď požehnáním či prokletím, jedem či lékem, pro milióny lidí afrického původu. Ačkoli významně neovlivňuje schopnost hemoglobinu přenášet kyslík, má jiné zásadní důsledky.
hemoglobin S (HbS) = hemoglobin srpkovité anemie. Mutace je v beta řetězci na 6. místě (místo glutamové kyseliny je přítomen valin). (Pozn.překl.)
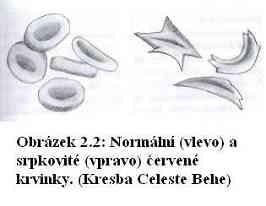
Roku 1904 zkoumal chicagský lékař James Herrick krev mladého černocha z Grenady, Waltera Clementa Noela, a zarazilo ho, když viděl, že jeho červené krvinky jsou znetvořené. (2). Místo obvyklého tvaru „záchranného kruhu“ (či „koblihy“) vykazovaly Noelovy krvinky bizarní tvary, včetně rohlíčků a srpků. Trvalo dalších čtyřicet let, než se zjistilo, proč jsou krvinky znetvořené. Po druhé světové válce prokázal poprvé vynikající vědec Linus Pauling, že hemoglobin lidí majících gen pro srpkovité krvinky se pohybuje při některých laboratorních testech líněji než normální hemoglobin. (3). Správně z toho vyvodil, že změna je ve struktuře hemoglobinu samotného. Bylo to poprvé, kdy byla objevena molekulární nemoc – nemoc způsobená odchylkou v biologické molekule. Uplynulo ještě deset let, než bylo objeveno, která konkrétní změna aminokyselin to má na svědomí (4).
V podstatě tahle jedna změna způsobuje, že se molekula chová, jakoby jedna její část byla silným magnetem. Navíc onen „magnet“ způsobuje, že jeden hemoglobin se nalepí na druhý a pak na třetí a tak dále, až se téměř všechen hemoglobin v buňce slepí dohromady. Srpkovitý hemoglobin se srazí v rosolovitou směs v každé červené krvince. To se stane teprve poté, co odevzdal kyslík a míří žilami zpět k srdci.
To, proč přesně toto vede k symptomům nemoci, včetně epizod kruté bolesti a smrti některých tkání, stále ještě plně nechápeme. Nejpopulárnější hypotézou je, že ztuhlé krvinky se mohou vzpříčit tam, kde se krevní řečiště zužuje – v nepatrných kapilárách, jejichž průměr je často menší než šířka typické červené krvinky. (Normální červené krvinky jsou velmi pružné a snadno kapilárami proklouznou). Krvinky uvízlé v zúžených místech by způsobily dopravní zácpu, zastavil by se průtok krve cévou, což by mohlo zabít krvinky i tkáně kvůli nedostatku kyslíku. Tenhle názor je však zpochybňován. Přece víme, že znetvořený tvar srpkovitých krvinek rozezná slezina jako cosi nenormálního, a krvinky jsou zničeny rychleji než je obvyklé, což vede k anemii. Je skličující, že ačkoli srpkovitá anémie byla první objevenou molekulární poruchou a uběhlo skoro šedesát let, věda nemá skoro nic pro léčbu této choroby.
Víme také, že lidem, kteří mají tuto nemoc a zdědili pro ni gen jen od jednoho z rodičů, nikoli od obou, nehrozí fatální následky. Asi polovina hemoglobinu v každé jejich červené krvince je srpkovité formy a druhá polovina ho nemá. Takoví lidé mají obvykle málo zdravotních problémů nebo žádné. Jedině když se dva nemocní vezmou, pak mají jejich děti šanci jedna ku čtyřem, že získají gen pro srpkovité krvinky od obou rodičů, a pak se u nich projeví nemoc v plné síle. Ve Spojených státech zhruba jeden z deseti afroameričanů má gen pro srpkovitost a asi sto tisíc jich onemocní. V některých oblastech Afriky má skoro polovina populace gen; mnozí z nich onemocní.
Z předchozí diskuse vychází obraz srpkovitého hemoglobinu jako čehosi strašného, úplné katastrofy. A mnozí lidé to jistě přesně tak pociťují. Avšak pokud by zde existovaly jen zápory, měli bychom po ruce skutečnou hádanku: Proč srpkovitá anemie přetrvala v populaci? Proč je tak rozšířená? Proč nemizí? Darwinova teorie evoluce říká, že za jinak stejných podmínek přežijí ti s nejlepšími geny. Ale vede-li gen srpkovitých krvinek k nemoci a smrti u lidí s dvěma kopiemi, proč jej přírodní výběr nemilosrdně nevykořeňoval tak dlouho, až by žádný nezbyl? Odpovědí je samozřejmě fakt, že ne vždy jsou všechny podmínky stejné. Ve Spojených státech je gen z valné části ryzí kletbou, ale v Africe může být požehnáním. Gen srpkovitých krvinek umožňuje odolnost vůči malárii.
EVA BEZ NEMOCI
Před mnoha tisíci lety v Africe sužované malárií, v komunitě lidí, kde mnoho žen prodělalo potrat či vidělo své děti umírat na horečku, zůstalo jedno dítě zdravé. Podobně jako ostatní děti pobodali tuto holčičku nesčetněkrát komáři, a občas onemocněla. Nemoc však nikdy nebyla vážná a holčička se brzy uzdravovala. Když dospěla, měla děti. Některé z jejích dětí byly s to hmyzímu bodnutí odolat, ačkoli jiné ho ne a umíraly. Její zdravé děti dospívaly, vstupovaly do manželství a měly děti vlastní. Jak míjely generace, stále více lidí v oblasti bylo potomky oné první zdravé holčičky. Nazvěme toto první prospívající dítě „Eva se srpky“, protože se stala matkou všeho živého, které má geny pro srpkovitý hemoglobin. Měli bychom ji však přejmenovat na „Evu bez nemoci“, protože osvobodila své potomky od smrtelné malárie.
U jednoho z rodičů Evy se srpky (z nichž ani jeden neměl zvláštní odolnost vůči malárii) došlo k nepatrné chybě, když se tvořilo buď sperma či vajíčko. Mašinérie pro věrné kopírování rodičovské DNA, která odvádí téměř bezchybnou práci, selhala. Místo přesné kopie byla zaměněna jedna (jedna!) z miliard nukleotidových složek DNA. DNA v oné rozmnožovací buňce, která poskytne polovinu genetické informace Evy se srpky, nyní zakódovala odlišnou aminokyselinu (valin) na šestém místě druhého řetězce hemoglobinu, místo obvyklé kyseliny glutamové. Druhá polovina genetické informace Evy se srpky vyšla od jejího druhého rodiče, který jí odkázal nezměněnou kopii hemoglobinu.
Žádný člověk v oné době nevěděl, proč mohla malá Eva se srpky pracovat a hrát si a žít, zatímco ostatní děti umíraly či úpěly na ložích pro nemocné. Ale malarický parazit to věděl – nebo spíše zjistil. Když byla malarická buňka náležitě vstříknuta do Evy se srpky kousnutím komára, bezstarostně si odcestovala do jejích jater a rutinně změnila formu. Nanobot měl po ruce veškerou svou standardní mašinérii k opuštění jater, rozpoznání červených krvinek Evy se srpky, k přilepení se na ně, jejich napadení, živení se jimi a pomnožení se. Predátor zajel k červené krvince, orientoval se, uvolnil příval enzymů a bílkovin v přípravě na pevné spojení, změnil svou konstrukci a vklouzl do krvinky.
Ale potom se cosi, z hlediska výhody pro predátora, hrozně zvrtlo. Jak se tak parazit živil, vnitřek červené krvinky Evy se srpky se změnil. Náhodné pohyby molekul vždy způsobují, že jednotlivé hemoglobiny do sebe vrážejí. Ale tentokrát, místo aby se odrážely od sebe, hemoglobiny se slepily. Víc a víc bílkovin ulpívalo jedna na druhé, a brzy začal celý roztok tekutého hemoglobinu krvinky gelovatět. Mazlavá, rosolovitá, polotuhá masa tlačila na vetřelce i na membránu červené krvinky, deformujíc její tvar. Jak byla unášena krevním řečištěm, prošla infikovaná krvinka slezinou dříve než měl parazit čas zakotvit na stěně žíly. Vždy připravená zbavovat tělo starých, poškozených krvinek, chňapla slezina po krvince, zkroutila ji a zničila včetně zabijáka schovaného uvnitř. Eva se srpky přežila, aniž měla ponětí o bitvě, kterou její hemoglobin vybojoval.
POTÍŽE A FUŠOVÁNÍ
Neviditelná mutace hemoglobinu, která se poprvé objevila u Evy se srpky, darovala zdraví mnoha jejím dětem i vnukům. Ale jak přešly generace a její potomstvo se rozrostlo, někteří potomci vstoupili do manželství s jinými potomky. A stalo se, že jeden muž a jedna žena měli oba geny pro srpkovitou anemii, které zdědili po svém předku. Jejich děti trpěly v různém směru. Dvě z osmi dětí tohoto páru byly nemocné od narození, se zvětšenými kostmi a slezinou; zemřely před desátým rokem věku. Místo pouze jedné kopie srpkovitého genu zdědily tyhle dvě ubohé děti vinou genetické loterie kopie dvě. Jak nyní víme, pokud se jen polovina hemoglobinu určitého člověka změní v srpkovitou formu, neztuhne hemoglobin sám od sebe. Potřebuje další podnět k tomu, aby zgelovatěl. Tímto podnětem je invaze malarického parazita. Metabolická aktivita parazita zvyšuje objem kyseliny v krvince a tak odstartuje srážení hemoglobinu. U těch šťastnějších potomků Evy se srpky jsou zničeny jen napadené buňky. Ale když veškerý hemoglobin v červené krvince je srpkovitý, není třeba zvláštního podnětu. Tyhle děti mají rozvinutou srpkovitou anemii, na rozdíl od verze s polovinou genů známou jako „srpkovitý rys“.
Srpkovitá anemie je genetickým rozsudkem smrti, zejména v oblastech bez přístupu k moderní lékařské péči. Avšak malárie je často také rozsudkem smrti. Abychom pokračovali ve svém shora uvedeném příběhu, ačkoli dvě z osmi dětí našeho manželského páru zemřely na srpkovitou anemii, ani dvě další nezanechaly potomky. Jedno z nich zemřelo na malárii a druhé, zmrzačené nemocí, nikdy neuzavřelo sňatek. Tyto dvě nezdědily žádnou kopii srpkovitého genu a netěšily se z výhody Evy se srpky. Čtyři zbývající děti, které zanechaly potomky, měly „srpkovitý rys“ – každé jednu kopii genů pro normální hemoglobin a jednu pro srpkovitý. Časem, jak se tyto zdravé děti ženily a vdávaly a plodily vlastní potomstvo, a jak další nositelé srpkovitého genu činili podobně, lidé „srpkovitého rysu“ vzkvétali. Tak zní příběh darwinovského úspěchu, jde však o úspěch chladné zákopové války. Přírodní výběr postavil neštěstí proti neštěstí, když byla zjednána rovnováha mezi pohromou malárie a prokletím srpkovité anemie.
Jak často vyvine náhodná mutace „přínosnou“ změnu jako je srpkovitý rys? Studiem DNA mnoha lidských populací došli vědci k závěru, že taková konkrétní mutace nevznikla nezávisle víckrát než v několika málo případech za uplynulých deset tisíc let – možná jenom jednou (5).
V evoluci jsou rovnováhy vytvářeny proto, aby byly narušovány. Kdyby, při fušování do mašinérie života, byla s to další mutace zmírnit ztráty na životech zaviněné srpkovitou anemií, aniž by se zmenšila ochrana proti malárii, pak by se mohl této variace zmocnit přírodní výběr a fungovat s ní. K tomuto procesu docházelo nesčetněkrát po generace v populacích afrického původu. Výsledky můžeme rozdělit do dvou kategorií. Budu se zabývat méně početnou, ale elegantnější kategorií později a začnu tou častější, ale méně šikovnou, čímsi, co se nazývá „dědičné přetrvávání fetálního hemoglobinu“ čili HPFH.
Jak jsem stručně poznamenal dříve, hemoglobin vlastně tvoří čtyři aminokyselinové řetězce navázané na sebe. Existují dvě kopie jednoho druhu řetězce (řetězce alfa) a dvě kopie podobného, ale samostatného řetězce (řetězce beta). Tak to alespoň vypadá u lidí po narození. Před narozením však existuje jiný druh hemoglobinu. Postnatální hemoglobin nám umožňuje užívat plíce k získávání kyslíku. Nenarozené dítě však musí získávat svůj kyslík od své matky, pupeční šňůrou. Fetální hemoglobin má trochu odlišný tvar, který mu umožňuje čerpat kyslík z matčina hemoglobinu, asi jako bychom užili silnější magnet k odstranění sponky na papír z magnetu někoho jiného. Fetální hemoglobin má dva řetězce alfa a dva gama (žádný beta řetězec). I když jsou dost podobné řetězcům beta, mají řetězce gama také řadu odlišností, které činí z bílkoviny silnější magnet pro kyslík.
Krátce před narozením přepínají naše těla automaticky z výroby fetálního hemoglobinu na výrobu hemoglobinu „dospělého“. Někteří lidé však i během svých životů pokračují ve výrobě určitého množství fetálního hemoglobinu. Jejich děti často činí stejně, což tvoří „dědičně přetrvávající“ část HPFH. HPFH pomáhá lidem trpícím srpkovitou anemií, zřejmě tak, že ředí srpkovitý hemoglobin v jejich červených krvinkách. Takže místo 100 procent srpkovitého, lidé s HPFH mohou mít jen 90 procent srpkovitého a 10 procent fetálního hemoglobinu. Lidé, kteří mají srpkovitou anemii, ale mají také HPFH, mají často mnohem mírnější klinické symptomy než mají lidé bez HPFH. Jejich anemie je mnohem mírnější; žijí déle, mohou mít děti, takže mohou předat své geny. S HPFH je den popravy často odložen nebo dokonce vůbec zrušen.
Co způsobuje HPFH? DNA lidské buňky kóduje desítky tisíc různých druhů bílkovin. Avšak ne všechny bílkoviny jsou třeba v tutéž dobu. Ve skutečnosti některé proteiny působí protikladně a musíme je oddělovat jeden od druhého. Například když člověk snědl vydatné jídlo, jeho tělo běžně vezme něco z přebytečného cukru a přemění ho na škrob, k uskladnění do pozdější doby, kdy bude potřeba energie. Když tahle doba nastane, rozštěpí tělo škrob na cukr, a ten spálí jako energii. Tyhle opačné chemické procesy jsou všechny katalyzovány enzymy v buňce. Pokud by všechny enzymy byly v činnosti po celou dobu, pak po vydatném jídle by se buňka pokoušela jak uskladnit tak spálit přebytečný cukr. Aby se zajistilo, že jsou správné proteiny vyráběny ve správný čas ve správném pořadí a ve správném množství, obsahuje DNA složité „kontrolní prvky“ – přepínače, které zapínají a vypínají geny. V případě HPFH jsou některé z těchto kontrolních prvků rozbité (6). Opět jde o zákopovou válku. Problém (ač malý) pro dospělé s HPFH je ten, že jejich hemoglobin jim dává méně kyslíku ze vzduchu v porovnání s hemoglobinem normálním. Fetální hemoglobin není určen pro dospělé, ale musíme-li už rozbít zámek či vyhodit do povětří most, abychom zachránili město, budiž.
Evoluce je snad zákopovou válkou, ale armády na obou stranách přežijí. Může-li levnější oběť zachránit prapor, bude šířeji používána, protože tyhle prapory nebudou tak slabé. Elegantnějším řešením problému smrtelnosti srpkovité anemie je cosi zvané hemoglobin C-Harlem. Jak napovídá jeho název, C-Harlem byl poprvé objeven u obyvatele města New Yorku (7). C-Harlem má mnoho společného se srpkovitým hemoglobinem – oba mají dva běžné řetězce alfa jakož i dva řetězce beta, které mají tutéž zaměněnou aminokyselinu v poloze číslo 6. Beta řetězce C-Harlemu mají však také druhou mutaci. Poloha číslo 73 se také změnila. Tahle druhá mutace vede k překvapivému chování. Směsi půl na půl C-Harlemu s normálním hemoglobinem rosolovatí přibližně stejně snadno jako směsi padesát na padesát normálního a srpkovitého hemoglobinu přítomných u lidí s rysem srpkovitých krvinek. Čistě srpkovitý hemoglobin rosolovatí silněji, ale čistý hemoglobin C-Harlem nerosolovatí vůbec!
Důležitým praktickým důsledkem je fakt, že lidé s jedním genem pro normální hemoglobin a jedním genem pro C-Harlem mají téměř veškerou ochranu proti malárii, kterou měla Eva se srpky. Ale ti s dvěma kopiemi C-Harlemu nemají ony zničující problémy, které mají lidé se srpkovitou anemií. Takže C-Harlem má výhody, ale ne zápory srpků.
Zatím se nezdá, že by se C-Harlem nějak zvlášť rozšířil. Jeho antimalarické vlastnosti nenalézají moc uplatnění v současném New Yorku. Jeho jedinou výhodou je, že nevede k srpkovité anemii, ale totéž platí i pro hemoglobin normální. V Africe by byl gen C-Harlem požehnáním (9), ale mutace C-Harlem se tam zřejmě ještě nevyskytla.
CO JE NA TOMTO OBRAZE V NEPOŘÁDKU?
Je nad slunce jasné, že rozšíření srpkovitého genu je výsledkem darwinovské evoluce – přírodního výběru působícího na základě náhodné mutace. Ve skutečnosti je zde stav věcí tak jednoznačný, že příklad srpkovitého genu je téměř vždy užíván při výuce studentů biologie v rámci výkladu o evoluci. Dokonce i v profesionální literatuře je srpkovitá anemie stále nazývána, vedle dalších mutací spojených s malárií, „jedním z nejlepších příkladů přírodního výběru působícího na lidský genom“. (10). Není divu – nalézáme zde všechny základní prvky: tlak na selekci ze strany malárie, jedinou malou změnu původního hemoglobinového genu. A navíc, vidíme další mutace stavějící na téhle a modifikující ji. Dědičné přetrvávání fetálního hemoglobinu (HPFH) je již rozšířeno v Africe, zmírňujíc problémy se srpkovitým genem. Gen C-Harlem, který staví přímo na základech srpkovitého genu a zcela by vyloučil nevýhody srpkovité mutace, se ještě neobjevil v Africe, kde by činil svrchované dobro, ale není prakticky pochyb o tom, že časem se tam tento gen, nebo cosi jako on, objeví. Snad, jak argumentují zastánci darwinovské evoluce, můžeme přeskočit přímo od tohoto původního příkladu k závěru, že veškerý život – složitou mašinérii buňky, lidskou mysl, a všechno mezi tím – můžeme vysvětlit týmž způsobem.
Můžeme však skutečně? Obrana obratlovců před invazí mikroskopických predátorů je věcí imunitního systému, ale hemoglobin není jeho součástí. Hlavním úkolem hemoglobinu jako součásti dýchacího systému je přenášet kyslík ke tkáním. Užívání hemoglobinu k odvracení malárie je aktem naprostého zoufalství, jako třeba užití televizoru k ucpání díry ve vodní Hooverově přehradě. I když ponecháme stranou otázku, kde se tu hráz i televizor vzaly – což není malý problém – , musíme uznat, že tenhle darwinovský proces je dohodou o nejmenším zlu. Armádu v zákopech postihuje ztráta za ztrátou. Ať už to dopadne jakkoli, v téhle válce podnikané náhodnou mutací a přírodním výběrem se funkce ztrácejí, nikoli získávají.
Hoover Dam = přehradní nádrž na řece Colorado (USA). Postavena 1931-36. Do 1949 největší vodní elektrárna na světě, 1 360 MW. (Pozn. překl.).
H. C. Hoover (1874 – 1964), 31. prezident USA (1929 – 1933). (pozn. překl.).
Srpkovitý hemoglobin není jedinou změnou, kterou malárie způsobila v lidském genomu. Prozkoumejme hrst dalších – změn, které se doslova zapsaly do krve mnoha lidí – , z nichž některé vznikaly nezávisle několiksetkrát za posledních deset tisíc let. Uvidíme, zda obraz náhodné mutace, který máme ze srpkovitého hemoglobinu, je výjimkou či pravidlem.
EVA – SÍTO
Jelikož prvotním cílem malárie je červená krvinka, nepřekvapuje, že hemoglobin prošel řadou evolučních změn. Kromě srpkovité mutace došlo též k dalším změnám v hemoglobinu, které zpomalují parazitův postup. Jednou ze změn, která je podobná srpkovitému hemoglobinu – ale s poučnými rozdíly – je cosi zvané hemoglobin C (11). Pozor, hemoglobin C není totéž jako hemoglobin C-Harlem.
hemoglobin C = patologický hemoglobin s mutací v beta řetězci. Je mírná hemolýza a splenomegalie, nemoc má benigní ráz. (pozn. překl.).
Podobně jako srpkovitý hemoglobin vykazuje hemoglobin C (zkratka HbC) pouze jeden rozdíl oproti hemoglobinu normálnímu ve své řadě aminokyselin. A opět jako u srpkovitého hemoglobinu, změna se objevuje v šesté pozici řetězce beta. Ale v případě hemoglobinu C je náhrada blízce příbuzná. Podobně jako aminokyselina, kterou nahrazuje, je tahle nová elektricky nabitá. Rozdíl mezi nimi je ten, že nová je nabita kladně, zatímco její předchůdkyně je nabita záporně.
Hemoglobin C není tak rozšířen jako hemoglobin srpkovitý, ale přece se objevuje často v některých oblastech západní Afriky. Na rozdíl od srpkovitého hemoglobinu HbC netuhne, takže se zdá, že nezpůsobuje sám o sobě závažné problémy, určitě ne tak závažné jako je srpkovitá anemie. Nicméně se zdá, že pomáhá lidem v boji proti malárii. Nevíme úplně přesně proč, ale pokusy naznačují, že HbC je méně trvanlivý než hemoglobin normální. Když malarický parazit vstoupí do červené krvinky, zvýšený tlak v ní zřejmě způsobí, že se zmutovaný hemoglobin spíše rozevře a vystaví parazita reaktivním molekulám kyslíku, které ho asi poškodí. Rozložený hemoglobin asi též nepřímo způsobí, že slezina krvinku zničí.
HbC umožňuje ochranu před malárií a nezpůsobuje ani zdaleka tolik problémů jako je tomu u srpku. Avšak HbC se nerozšířil v Africe, aby nahradil srpkovitý hemoglobin. Proč ne? Odpověď najdeme u lidí, kteří dostanou jeden gen pro hemoglobin C od jednoho rodiče, ale normální gen pro běžný hemoglobin od rodiče druhého – „heterozygotů“. Ačkoli pouhý jeden srpkovitý gen dává skvělou ochranu proti malárii, jeden gen hemoglobinu C dává pouze malé množství ochrany. Aby dostal plnou dávku ochranné síly, musí člověk mít dvě kopie genu C (12); jinými slovy, musí zdědit jeden gen od každého z rodičů. Ironií tedy je, že zatímco dvě kopie srpkovitého genu zabíjejí, dvojnásobná dávka genu C léčí. Na druhé straně, zatímco jediný srpkovitý gen léčí, jediný gen C mnoho nezmůže.
Abychom zjistili, proč je hemoglobin C omezen na několik málo oblastí Afriky, srovnejme osudy Evy se srpky, prvního člověka, který měl zmutovaný srpkovitý gen, a jiné dívky, kterou nazvu, neelegantně, „Eva C“. Šlo o prvního člověka, který měl zmutovaný gen C. Jestliže jsme nazvali Evu se srpky „Evou bez nemoci“, pokračujme chvíli v této hře a nazvěme Evu C „Evou-sítem“, protože až příliš často uniká ochrana před malárií z dosahu jejích možností.
Když se Eva se srpky narodila, prospívala a po komářích kousnutích se jen otřepala, zatímco jiné děti v její vesnici po nich onemocněly a umíraly. Asi polovina jejích vlastních dětí zdědila její imunitu a její potomstvo rychle svým počtem převýšilo potomky jiných vesničanů. Teprve později, když se srpkovitý gen stal dost běžným na to, aby měl po jedné kopii každý z manželské dvojice, vznikly problémy, když některé děti zdědily dva srpkovité geny a tak srpkovitou anemii. Na rozdíl od toho, když se narodila Eva C v sousední vesnici, nebyla na tom lépe než většina jiných dětí v oblasti. Jako batole ji stále štípali komáři nakažení malárií. Jako mnoho jiných dětí i ona trpěla horečkami a často byla zoufale nemocná. Ale osud tomu chtěl, že byla součástí té skupiny dětí, které přežily do věku pěti let či tak nějak, kdy se značně zmenšuje hrozba smrti na malárii (13). Eva C vyrostla, vdala se a přihlížela v bezmocné agónii tomu, jak polovina jejích dětí zemřela, buď v důsledku potratu či horečky jako kojenci a batolata.
Druhá polovina dětí Evy C však přežila, vyrostla a měla vlastní děti. Když se někteří z těchto potomků přestěhovali do původní vesnice Evy se srpky a vybrali si tam partnery, jejich děti byly chráněny před malárií mnohem hůře než mnoho jiných dětí ve vesnici – potomků Evy se srpky – , takže jejich linie rychle v oné vesnici vymřela. Avšak potomci, kteří zůstali v původní vesnici Evy C, přesáhli počet potomků jiných žen ve vesnici. Polovina dětí Evy C měla mutaci (s malým účinkem), a když ti praví potomci měli děti, čtvrtina z těchto dětí měla jak mutace tak mnohem větší naději na přežití. A přece, když jejich děti vyrostly a vstoupily do manželství, často by jejich děti neměly ani tolik odolnosti jako jejich matka, na rozdíl od dětí Evy se srpky. Časem však se přece ve vesnici rodilo víc a víc šťastných dětí, z nichž některé spolu uzavřely sňatek a jejich děti měly vždy silnou odolnost. Byl tu však háček. Když se potomci Evy C přestěhovali do jiné vesnice a vzali si místního chlapce či dívku, jejich děti ztratily odolnost. Takže aby potomstvo Evy C prosperovalo, muselo zůstat blízko domova a, podobně jako Charles Darwin, vzít si svoji vlastní sestřenici (14). (Zatímco děti Evy se srpky mohly šířit svou výhodu v celém širém světě).
S pokrokem ve vědě nyní dokážeme pochopit důvody jsoucí za těmito zdánlivě náladovými výkyvy osudu, které by jistě byly záhadou pro Evu C a její potomky. Jelikož srpkovitý gen propůjčuje odolnost vůči malárii jen při jedné kopii, prosperovala Eva se srpky od počátku stejně jako mnoho jejích potomků, než si vzali jeden druhého a některé děti zdědily dvě kopie srpkovitého genu. Ale jelikož gen hemoglobinu C potřebuje dvě kopie, aby byl účinný, a v jediné kopii poskytuje pouze malé množství odolnosti vůči malárii, pak to Eva C neměla lehčí než ostatní lidé z její vesnice. Jak vzrůstal – zpočátku prostě náhodou – procentní podíl potomků Evy C na populaci vesnice, pak jim ono malé množství ochrany díky jedné kopii genu C počalo dávat statisticky lepší šanci na přežití než oněm bez kopie, takže gen C se začínal prosazovat.
Když mělo více vesničanů gen C, byla i větší pravděpodobnost, že dva z nich se vezmou a budou mít alespoň několik dětí, které mají dvě kopie genu C, a tedy plnou ochranu před malárií. Když tyhle zdravé děti vyrostly a vzaly si jiného obyvatele vesnice, bylo stále spíše pravděpodobné, že většina či všechny jejich děti budou mít jen jediný gen C. Ale kdyby se tyhle šťastné děti přestěhovaly do jiné vesnice, kde nebyl nikdo s genem C, pak by děti z tohoto sňatku obyvatel dvou vesnic měly nutně jen jediný gen C a tak by ztratily téměř veškerou ochranu před malárií, kterou měl jejich rodič (15). Takže aby prosperovaly, musely děti zůstávat blízko domova a raději si brát blízké příbuzné.
Dobrou stránkou hemoglobinu C je, že lidé se dvěma zmutovanými geny mají málo zdravotních problémů, na rozdíl od lidí buď se dvěma srpkovitými geny (kteří mají srpkovitou anemii) či od lidí se dvěma normálními hemoglobinovými geny (kteří jsou náchylní k malárii). Záporem je to, že gen C se šíří jen velmi pomalu. V boji jednoho proti druhému by měl gen C nahradit srpkovitý gen v endemických malarických oblastech za dost dlouhou dobu, za jinak stejných podmínek, protože předností genu C je to, že odolává malárii stejně jako gen srpkovitý, bez závažného vedlejšího negativního účinku. Protože jsou však věci jen zřídka kdy v rovnováze, je tato předpověď daleko od jistoty (16).
POUČENÍ
Odpočiňme si zde na chvíli, abychom se zamysleli nad některými jednoduchými problémy týkajícími se srpkovité mutace a mutace HbC. První záležitostí je fakt, že jak srpkovitá tak HbC jsou v podstatě zhoubnými mutacemi, protože omezují fungování lidského těla. Obě zaviňují anemii a mají další zhoubné účinky. Ve šťastnějších dobách by se nikdy v lidských populacích neuchytily. Ale v dobách zoufalství, kdy městu hrozí invaze, může být výhodnější bez dalšího přemýšlení spálit most, abychom tuto invazi odvrátili.
Druhým problémem je fakt, že mutace se navzájem nespojují, aby vytvořily komplexnější, interaktivní biochemický systém. Srpkovitá mutace i mutace C se vzájemně vylučují a soupeří o tutéž pozici na hemoglobinu – šesté místo na řetězci beta. Nehodí se k sobě, aby vytvářely něco komplexnějšího. Příbuzným problémem je to, že ani jedna z hemoglobinových mutací se neobjevuje v imunitním systému, systému, který je v zásadě odpovědný za obranu těla před mikroskopickými predátory. Takže mutace ani netvoří nový systém a dokonce ani nepřidávají nic k systému již zavedenému. V této knize nám jde o to, jak může být vybudován mechamismus. Abyste postavili složitý stroj, musíte sestavit mnoho různých dílů a přizpůsobit je jeden druhému.
Posledním, důležitým bodem je fakt, že byť i jen s těmito dvěma prostými mutacemi je proces spletitý až téměř do nesoudržnosti (17). Byť jen se srpkovitým genem a genem C – s výhodou heterozygotů verzus homozygotů a s různými škodlivými účinky – je interakce zmutovaného genu s normálním chaotická a složitá. Srpek je lepší na počátku, avšak C je lepší na konci; srpek se šíří rychle a dostává se na vrchol, než může C začít působit; nositelé srpkovitého rysu jsou lépe chráněni, když si vezmou někoho mimo vlastní rodiny, kdežto nositelé rysu C udělají lépe, když si vezmou příbuzného; a tak dále. Není těžké si představit pár dalších mutací vynořivších se na hemoglobinu či jiných genech, jež by učinily celý proces opravdu mazaným ve své složitosti a protichůdných zaměřeních. Chaotická interakce genů není vůbec konstruktivní. V každodenním světě naší zkušenosti, kde se proplétá mnoho nespojitých vláken, není výsledkem hezký gobelín – je jím gordický uzel. Vede i do těchto konců darwinovská evoluce?
MUŽ PŘES PALUBU
Mutace, které ústí do srpkovitého hemoglobinu a HbC, jsou obě lehké. V těchto případech jediná změna ve specifickém nukleotidu – jedním ze stavebních kamenů DNA – postihla gen pro beta řetězec hemoglobinu tak, že pouze jediná aminokyselina se lišila od normálu ve zmutovaných bílkovinách. Existují však hrubší, drastičtější mutace, které také pomáhají ve válce s malárií. V této sadě mutací je vyhozen celý gen – buď náhodně vypuštěn či změněn tak, že už neprodukuje funkční bílkovinu. Je-li touto bílkovinou hemoglobin, nazýváme výslednou skupinu stavů „talasemií“ podle řeckého slova pro moře, protože byla poprvé zjištěna u lidí, kteří žili u Středozemního moře. A talasemie je skutečně rozšířena v Africe, na Středním východě a v Asii.
Zdravé hemoglobiny mají čtyři řetězce – dva řetězce alfa a dva řetězce beta. U osoby s talasemií je však exemplář genu pro jeden druh řetězce hemoglobinu buď vypuštěn či vypnut. To je příčinou nerovnováhy v celkovém množství řetězců, které buňka vyrábí. U některých talasemií existuje převaha řetězců beta; u jiných mají převahu řetězce alfa. Talasemie, u nichž schází řetězec alfa, vedou obvykle k lehčí anemii než když chybí řetězec beta. U většiny talasemií alfa je vypuštěn celý gen. Následky takového vymizení se mohou podstatně lišit. Normálně mají lidé čtyři geny alfa a dědí tedy po dvou od každého rodiče. Alfa – talasemickým dětem alfa – talasemických rodičů může chybět jeden, dva, tři či všechny čtyři geny alfa. Chybějí-li pouze jeden či dva geny alfa, pak zbývající dva či tři geny alfa zřejmě kódují dostatečně dlouhý řetězec alfa, aby poskytl červené krvince dost fungujícího hemoglobinu k jakés takés existenci. Nejsou-li přítomny žádné geny alfa, umírá dítě před narozením.
Srpkovitý hemoglobin i hemoglobin C jsou velmi specifické mutace, každá způsobena jednou konkrétní aminokyselinou. Na rozdíl od toho mnoho – asi sto – různých druhů mutací blokuje produkci řetězce beta a výsledkem jsou talasemie (18). Někdy je vypuštěn celý gen beta. Jindy ztratí zmutovaný gen důležité výrobní signály, což vede buď ke znetvoření řetězce beta či k poklesu množství řetězce beta, které může gen vyrobit. V jiných případech pár či dokonce pouze jeden nukleotid jsou změněny v genu beta, což jej činí zcela nefunkčním. Protože existuje tak mnoho různých mutací, které mohou způsobit talasemii na rozdíl od pouhé jediné, která může způsobit srpky či hemoglobin C, náhodné talasemie vznikají mnohem častěji. Šíří se rychle v oblastech malárie a dřív, než zvláštní mutace jako jsou srpky mají šanci vůbec odstartovat.
Talasemie je další zhoubná mutace jako srpkovitý hemoglobin nebo HbC. I ve své nejmírnější formě znamená omezení funkce systému, který dodává do tkání kyslík. Talasemie je však užitečná v tom, že zpomaluje invazi malárie. Studie prokázaly, že ačkoli talasemie nechrání ani zdaleka tak dobře jako jedna kopie genu srpkovité anemie, přece jen zabezpečuje asi 50 procentní ochranu proti malárii (alespoň jeden typ talasemie tak činí), patrně tak, že činí červenou krvinku křehčí (19). Je to most, který můžeme spálit, abychom odvrátili útok malárie.
DALŠÍ GENY ČERVENÝCH KRVINEK
Hemoglobin je dobrý protein k ovlivňování boje s malárií, protože je to nejčastější bílkovina v červené krvince. Nepracuje-li hemoglobin právě dobře – rosolovatí-li či je nestabilní – , pak červená krvinka, v níž malárie putuje, nebude tak silná a bude mít kratší životnost. Jakýkoli dodatečný tlak na křehkou buňku od malarického parazita ji může rychle posunout za hranici a způsobit, že ona i parazit jsou zničeny slezinou. Nepřekvapí, že tak mnoho různých mutací hemoglobinu prosperovalo v oblastech s malárií, jelikož existuje mnoho různých způsobů, jak stroj zablokovat.
Ale ačkoli je hemoglobin nejčastější bílkovinou v červené krvince, jistě není jediný. Když zmutují některé z dalších bílkovin červené krvinky, osoba získá jistou odolnost vůči malárii. V této kapitole se stručně zmíním o některých z těchto bílkovin. Poučení, které z nich plyne, je toto: Stejně jako u hemoglobinu, i zde jsou mutace spojeny s úbytkem funkce bílkoviny nebo jejím celkovým vypuštěním. Čtenáři, kteří nepovažují za nutné věnovat pozornost technickým detailům zde uváděným, možná raději zbytek této kapitoly přeskočí.
Jedním z užitečných hejblátek nanobota červené krvinky je bílkovina zvaná „glukosa-6-fosfátdehydrogenáza“, kterou lze (naštěstí) zkrátit jako G6PD. G6PD je odpovědná za výrobu „omezující energie“ v buňce, kterou si můžeme představit jako cosi podobné antacidu. Červená krvinka má nebezpečnou práci. Krvinku přenášející spoustu kyslíku můžeme přirovnat k člověku nesoucímu láhve s kyselinou. Jednou za čas jedna z těchto láhví náhodou upadne a rozbije se a člověk bude postříkán a popálen. V červené krvince je kyslík jako kyselina a hemoglobin jako láhve. Ačkoli hemoglobin odvádí dobrou práci, i za nejlepších okolností občas molekula hemoglobinu „praskne“ , kyslík (či chemicky příbuzný materiál) unikne a buňka se může spálit. Aby se vyrovnala s očekávaným prasknutím, G6PD vede ke sloučenině (zvané glutathion), která pod vedením dalšího opravného mechanismu vysaje rozlitý kyslík, čímž omezí škodu na minimum.
Úklidová G6PD činí červenou krvinku křehčí, což, jak jsme viděli, může být čistou výhodou během invaze malárie (20). Nakažené, křehčí buňky slezina snadněji najde a zničí. Jsou známy stovky mutací, které mění sled aminokyselin u G6PD a buď zničí či značně omezí její účinnost. Podle povahy mutace a podle toho, zda se objeví u muže či ženy (21), může vést k anemii. Protože gen G6PD může rozštěpit tak mnoho různých mutací, je četnost jejich výskytu mnohem, mnohem vyšší než četnost výskytu mutace pro srpkovitý hemoglobin. Mutace G6PD jsou rozšířeny v malarických oblastech celého světa, od Afriky po Asii. Studie naznačily, že mohou poskytnout zhruba tentýž stupeň ochrany proti malárii jako talasemie (22).
Další bílkovinná mašinka, která se za normálních okolností stará o to, aby byl nanobot červené krvinky aktivní, se nazývá „Band 3“ protein (páskový protein 3). Tento protein nacházíme v membráně červené krvinky. Jeho úkolem je být branou látkové výměny a umožňuje některým druhům potřebných materiálů vstupovat do buňky a pumpuje z buňky odpady (23). V některých malarických oblastech, zejména v Melanézii, zahrnuje populace vysoké procento lidí s defektními geny pro protein Band 3, což opět zdá se přináší určitou odolnost vůči malárii (24). Jak k tomu dochází, není jasné. Snad je to také zde podmíněno zvýšenou křehkostí červené krvinky. Nebo tomu může být tak, že se snadněji než obvykle tvoří sraženiny. Sražené bílkoviny Band 3 jsou normálně signálem toho, že buňka (krvinka) stárne a tělo určí tyto krvinky ke zničení (25). V některých oblastech je zastoupení populace s jednou kopií defektního genu pro páskový protein 3 docela vysoké (kolem 20 procent), ale nejsou zde zastoupeni lidé se dvěma defektními kopiemi. Krutá pravda, která z toho plyne, je fakt, že zdědění obou defektních kopií zabíjí dítě před narozením. Je to vysoká cena, kterou lidé platí, ale zřejmě menší zlo než snášet naplno břemeno malárie.
Malárie se usadí na červené krvince tak, že se zachytí na jistých bílkovinách, které se podobají anténkám na povrchu buněk. Jednu z „anténkových“ bílkovin vystupujících z povrchu červené krvinky nazýváme „Duffyho antigenem“. Jeden druh malarického parazita zvaný Plasmodium vivax (méně škodlivý příbuzný osudného P. falciparum ) se na tomto antigenu s oblibou usazuje před invazí do červené krvinky. Téměř všichni lidé v západní a střední Africe jsou však zcela imunní vůči malárii způsobené P. vivax, protože jejich červené krvinky už Duffyho antigen nevyrábějí. Je tomu tak díky změně jediného nukleotidu v DNA (26). Podobně jako HbC musí být zmutovaný gen přítomen ve dvou kopiích, aby se získala skutečná výhoda v boji proti malárii. Vypnutí Duffyho antigenu v červených krvinkách prakticky neškodí, ačkoli může být spojováno se zvýšeným rizikem rakoviny prostaty.
Richard Duffy (1906-1956), britský hemofilik, u kterého nastala po transfuzi reakce a při srovnání jeho krve s krví dárce v ní byl objeven nový antigen, důležitý pro odolnost vůči maláriovým parazitům (pozn. překl.).
Známe též některé další mutace, které pomáhají v boji proti malárii, ale ty, které jsme zatím probrali, jsou nejtypičtější. Základní poučení zde zní: Všechny škodí. Některé jsou horší než jiné, ale všechny omezují správnou funkci; žádná není konstruktivní. Podobně jako srpkovitý hemoglobin jsou všechny aktem zoufalství ve snaze za každou cenu odvrátit invazi.
TABULKA 2.1
Účinky zákopové války proti malárii na lidský genom
„Tohle břemeno netvoří jen přímé účinky malárie, nýbrž i velká zátěž oslabujících a někdy smrtelných zděděných nemocí, které byly vybrány pod jejím tlakem v minulosti“ (Carter a Mendis, 2002, str. 589).

ZPĚT DO DOBY KAMENNÉ
Skoro po celou druhou polovinu dvacátého století se Spojené státy a Sovětský svaz utkávaly ve vzájemném řinčení zbraní krajně nervy drásajícím způsobem. Slovní výhrůžky byly zaštiťovány hrozivými závody ve zbrojení. Spojené státy vyvinuly jaderné zbraně, pak to učinil i SSSR. Jedna strana vyrobila větší zbraně; druhá zlepšila přesnost těch svých. Jedna strana umístila zbraně na území států blízko druhé strany; druhá strana je umístila na ponorky. Jedna strana vyvinula systém antiraket; druhá vymýšlela složitá zařízení, jak se těmto střelám vyhnout. Nějakým zázrakem nebyly ještě zbraně použity, ale neexistují žádné záruky do budoucna.
Zbrojní závody v balistických střelách a podobné technologie mezi lidskými supervelmocemi podnikaly samozřejmě inteligentní bytosti jednající účelně k dosažení určitého cíle (jakkoli špatného). To je prakticky absolutní opak darwinovské evoluce, která předpokládá pouze slepé, bezúčelné genetické náhody, z nichž některé mohly být upřednostněny automatickou činností přírodního výběru. Někteří darwinisté nicméně tvrdili, že vidí v lidských závodech ve zbrojení dobrou analogii slepé evoluce. Například: Dejme tomu, že v dávné minulosti předci moderních gepardů začali lovit předky moderních gazel. V oné době byli oba relativně pomalí ve srovnání se svými potomky, ale i tak někteří z rychlejších gepardů chytili některé z pomalejších gazel. Po obědě se párky rychlejších, lépe živených gepardů stáhly do houští, aby zplodily více potomstva než hladoví, pomalejší gepardi; loudavé gazely prostě zmizely v gepardích žaludcích, zatímco ty rychlejší přežily. Přírodní výběr v akci.
Občasná náhodná mutace, která učinila geparda či gazelu trochu rychlejšími, prý zvýhodňuje jejich potomky, takže, jak se praví dále, rychlejší gepardi prý připravili půdu pro evoluci rychlejších gazel a vice versa. Po mnoho generací se jak gepardi tak gazely stávali rychlejšími, i když průměrné množství gazel sežraných gepardy mohlo zůstávat zhruba stejné. Takže vzájemnou soutěží se prý tyto dva druhy zlepšovaly, ačkoli ani jeden prý úplně nepředčil toho druhého. Další nálepka, kterou tento koncept dostal, je „efekt Červené královny“ podle hloupé odpovědi Červené královny Alence, že v Říši divů musíte běžet tak rychle jak jen umíte, jen proto, abyste se udrželi na jednom místě. Tahle myšlenka je stejná jako v evoluci: druh i jeho nepřátelé se všichni musí neustále zlepšovat jen proto, aby přežili.
Na první pohled zní myšlenka závodů ve zbrojení přijatelně a někteří horliví darwinisté ji prohlásili za snad nejdůležitější faktor v pokrokové evoluci – stavbě soudržných, složitých soustav. Ve své klasické knize obhajující Darwina, Slepý hodinář, prohlásil oxfordský biolog Richard Dawkins:
Považuji závody ve zbrojení za nanejvýš důležité, protože jsou to právě do značné míry závody ve zbrojení, které daly podnět k oné „pokrokovosti“ v evoluci. Neboť, na rozdíl od dřívějších předsudků, na evoluci není nic imanentně pokrokového. (27)
A:
Myšlenka závodů ve zbrojení zůstává zdaleka nejuspokojivějším vysvětlením pro existenci vyspělé a složité mašinérie, kterou disponují zvířata i rostliny (28).
V Dawkinsových vývodech o důležitosti závodů ve zbrojení pro evoluci je přání otcem myšlenky. Abychom tomu oponovali, zamysleme se nad příkladem geparda a gazely, ale trochu skeptičtěji. Jak by se mohla gazela lépe vyhnout rychlejšímu gepardovi? Jeden způsob, jak se to vyjadřuje standardním způsobem, je stát se rychlejší sama. Ale jiný způsob by mohlo být zlepšit se v rychlých kličkách, aby se gazela vyhnula predátorovi ve štvanici. Nebo vyvinout silnější rohy na obranu. Nebo silnější kůži. Nebo více vyrůst. Či vyvinout mimikry. Nebo se pást tam, kde gepardi nejsou. Či když gepardi spí. Nebo blízko lesa, v němž se můžeš schovat. Nebo zvolit kteroukoli ze stovek dalších strategií. Nebo vše zmíněné dohromady. Podobně jako je mnoho různých způsobů, jak se lidské geny mohou změnit, aby pomohly zapudit malárii, i gazely by se mohly změnit četnými, různorodými způsoby.
Příběh Tak-nějak se zdá být nejprve přijatelný jen proto, že se zarputile zaměřuje jen na jeden rys – rychlost – a zanedbává zbylé nesčetné možnosti. Ale v reálném světě nemá darwinovská evoluce žádný pohled, který by někam zaměřila; je slepá. Ve slepém procesu nemůže existovat vědomé budování jediného rysu, rozvíjení a zlepšování konkrétního znaku. Cokoli, co momentálně funguje pro okamžitý efekt, bude vybráno, ať už je to „pokrokové“ či nikoli – k čertu s budoucností. Potomci trochu rychlejší gazely třeba mohou pokračovat tak, že vyvinou trochu lepší mimikry či trochu jiné strategie pastvy či se trochu změní v kterémkoli z nesčetných jiných znaků, zanedbávajíce potřebu zvýšené rychlosti. Pokud by tomu tak bylo, pohyb gazel by se prostě průběžně nezrychloval. Měnily by se časem tisícerými, nespojitými, různorodými způsoby. Není důvod pro očekávání, že by se v darwinovských zbrojních závodech koherentně vyvíjel jediný znak.
Možná, že nevíte, komu věřit v této otázce, jelikož já prostě stavím proti Dawkinsovým tvrzením svá vlastní. Zvažte však následující. Ačkoli existují některé studie ukazující na skromné závody ve zbrojení u menších zvířat – mravenců, jiných bezobratlých a mikroorganizmů – , neexistují absolutně žádné studie, které by dokumentovaly fakt, že by se velká zvířata měnila způsobem, který předpokládá Dawkins. Nejvíce víme o „zbrojních závodech“ mezi parazity a hostiteli. Zdaleka nejrozsáhlejší důležitá data, která máme o účincích evoluce na soutěžící organizmy, jsou data shromážděná o vztazích mezi lidmi a našimi parazity. A jako v případě malárie, ukazují tato data na zákopovou válku, s činy zoufalé destrukce, nikoli na závody ve zbrojení, se vzájemným zlepšováním.
Vzájemné přetahování v evolučním procesu člověk-malárie se nic nevybudovalo – pouze to věci ničilo. Odvrhování G6PD působí degeneraci, nekonstruuje nic. Odbourávání proteinu Band 3 působí stejně. Srpkovitý hemoglobin neznamená samo o sobě zdokonalení imunitního systému; jde o regresi červené krvinky. Dokonce ani zrušení normální kontroly u HPFH nevytváří nový systém; jenom ucpává další díru v hrázi.
Samotná metafora závodů ve zbrojení je nedomyšlená. Vztah mezi malárií a lidmi je vztah boje na života a na smrt. Jenže reálné závody ve zbrojení vedou vysoce inteligentní, obrýlení inženýři v prosklených kancelářích, kteří promyšleně navrhují nablýskané zbraně na moderních počítačích. Ale v blátě a zimě zákopů přírody se nemyslí. Přinejlepším jsou zbraně v přírodě ušité horkou jehlou mezi výbuchy a zmatkem kouřících bitevních polí, jsou nepatrnými variacemi těch skutečných – díly drží asi jakoby byly spojené žvýkačkami. Nefungují-li, hodí se na nepřítele prostě něco jiného, včetně kuchyňského dřezu – není na tom nic „pokrokového“. A většinou dochází k nejhoršímu – zákopová válka je válkou opotřebovávací. Může-li být nepřítel zastaven či zpomalen tak, že spálíme své vlastní mosty či vybombardujeme vlastní rozhlasové vysílače či ropné rafinérie, tak jen do toho. Darwinovská zákopová válka nevede k pokroku – vede zpět do doby kamenné.
Ve skutečné válce se všechno nemilosrdně zhoršuje. Ve své skutečné válce s malárií lidský genom jenom utrpěl.
ČÍM VÍC, TÍM LÍP
I když jsme bytosti prosáklé marností, žádný problém nás nezaměstnává více než my sami. Toto zaměření na nás lidi zřejmě pokrucuje celý obraz. Naše města se sice mohou zdát přeplněná, ale počet lidí na zemi je vlastně nepatrný ve srovnání s počtem mikroskopických tvorů. Každý člověk na světě, který je nemocný malárií, hostí zhruba trilión parazitů. Čím více jedinců určitého druhu existuje a čím kratší je životnost každé generace, tím se naskýtá více příležitostí pro přínosné mutace. Abychom si lépe představili, co dokáže náhodná mutace a přírodní výběr – darwinovská evoluce – , zamysleme se nad velmi početným druhem, samotným Plasmodium falciparum. Jak se vyvinula tahle smrt kosící milióny za dobu své koexistence s lidmi?
3. Kapitola: Matematické meze darwinizmu
Po tisíciletí bojovali lidé s malárií v nevědomé válce, kde jedinou obranou bylo opotřebovávání v evolučním procesu náhodných mutací a přírodního výběru předpokládaném Charlesem Darwinem. Ale v posledních pěti stech letech se povaha této války změnila zásluhou radikálně odlišného faktoru. S použitím své schopnosti uvažovat se člověk časem dověděl mnohé o světě, který byl našim předkům skryt. Zejména objev mikroskopických dravců (parazitů) nám umožnil začít bojovat s nepřítelem. Než bychom čekali na to, až se dostaví šťastná mutace, objevovali jsme a pak i vynalézali léky, které mohou malárii zabít. Nejprve byla tato nová, racionální fáze války omezena na využívání rostlin, které poskytovala sama příroda. V uplynulém tři čtvrtě století však pokroky v chemii, lékařství a základním biologickém výzkumu vedly k novým lékům, které si příroda vůbec nedovede představit.
Prvotním triumfem bylo vítězství na celé čáře všude tam, kde se lidé s malárií pustili do boje. Krutí malaričtí parazité hynuli po nesčetných trilionech. V oněch opojných dnech 50. let 20. století se hodně mluvilo o úplném vymýcení malárie. Lidstvo prý bude brzy žít ve světě osvobozeném od své prastaré pohromy. Optimizmu bylo na rozdávání. V téže době vědci mysleli, že i ostatní maličké metly – virulentní bakterie, viry a dokonce i škodlivý hmyz v zemědělství – mohou být zlikvidováni léky a insekticidy. Raná vítězství na těchto frontách se také snadno dostavovala.
Nálada je však dnes chmurnější. Zázračné léky jsou na ústupu či selhaly. Titulek nedávného článku v časopisu Science, „Rekviem za chlorochin“ (1), se týká léku, který byl po desetiletí standardem v léčbě malárie. Ty tam jsou řeči o konečném vítězství nad malárií, nahrazované skromnými nadějemi, že snad ji alespoň udržíme na uzdě. Zdá se dokonce, že malárie je v současné době v Africe na vzestupu (2). Ačkoli to ještě nevypadá na to, že bychom byli zatlačováni do špatných starých časů, dostala se válka mezi lidstvem a P. falciparum do znepokojivé slepé uličky. K našemu zármutku dokazuje neočekávaná tvrdošíjnost parazita, že evoluce si dělá co chce s přáteli i s nepřáteli. Eva se srpky není jediná, kdo těží ze šťastné mutace. P. falciparum zná onu fintu také. Také v tom spočívá něco z nejlepších možných důkazů pro darwinizmus – stejně jako jasný důkaz jeho mezí.
PŘÍRODNÍ LÉČBA
Po staletí zaznamenaných dějin, i když byly její vinou vyhlazovány celé civilizace, zůstávalo lidstvo vůči malárii bezmocné. Hippokratés – sám otec lékařství – připisoval její periodické horečky nerovnováze čtyř tělesných „šťav“ (krev, sliz a černá a žlutá žluč). Středověcí lékaři měli za to, že horečky způsoboval špatný vzduch (mal´aria je italsky špatný vzduch) vystupující v létě ze smrdutých močálů. Léčba zahrnovala použití pijavic k pouštění žilou – ve zpětném pohledu ne nejlepší postup pro lidi trpící anemií způsobenou malárií.
Moderní boj proti malárii začal objevem, že prášek vyrobený z kůry chinovníku v jihoamerických Andách se hodil k léčení horečky. Ačkoli ho patrně místní kmeny nepoužívaly k léčbě malárie, evropští osadníci ho v sedmnáctém století přivezli přes Atlantik do Evropy, kde byl poprvé použit náhodně u malarických pacientů. Když bylo chinovníkovou kůrou vyléčeno několik členů královské rodiny, poptávka prudce stoupla. Chinovník začali pěstovat pro export Holanďané na svých indonéských koloniálních plantážích. Kůra začala být široce dostupná a doslova změnila svět. S chininem z kůry chinovníku mohli Evropané kolonizovat a provozovat obchodní podniky v tropech, obvykle pomocí afrických či indiánských dělníků, kteří díky srpkovitému rysu či talasemii byli do jisté míry přirozeně odolní vůči malárii.
Chinin, aktivní složka, byl poprvé izolován z kůry chinovníku francouzskými chemiky počátkem devatenáctého století. Trvalo však až do 40. let 20. století, než význačný organický chemik Robert Woodward vyrobil tuto sloučeninu uměle ve své laboratoři na Harvardu. Ve 30. letech 20. století vyvinula jedna německá farmaceutická firma umělý antimalarický lék podobný chininu. Během 2. světové války zabavila americká armáda tajný sklad tohoto léku, který přejmenovala na chlorochin. Podobně jako chinin tvoří i chlorochin relativně malá molekula (nikoli velká makromolekula) a má jadernou strukturu zvanou „chinolin“. Chlorochin je jednodušší molekula než chinin a lze ho tedy mnohem snadněji syntetizovat v laboratoři. Kvůli své účinnosti a nízkým produkčním nákladům se stal chlorochin po desetiletí nejlepším lékem pro léčbu malárie.
chinolin = bazická, světlo silně lámající kapalina charakteristicky zapáchající; mísí se s alkoholem a etherem, má antiseptické účinky. (pozn. překl.).
Za pár let po zavedení chlorochinu se však začaly vynořovat zprávy o jeho selhání při léčbě některých pacientů. A jak ubíhal čas, zprávy byly čím dál častější, a v 80. letech 20. století byl chlorochin neúčinný proti většině případů P. falciparum. Abychom pochopili, jak chlorochin kdysi působil a proč selhal, prohlédněme si některé šrouby a matice malarického nanobota.
TOXICKÝ ODPAD
P. falciparum se živí hemoglobinem uvnitř lidské červené krvinky. Je tu však háček. Ačkoli parazit umí strávit bílkovinnou část hemoglobinu – rozštěpí ji na aminokyseliny, které pak znovu využije k tomu, aby mu pomohly vyrábět kopie sebe sama -, neumí využít hemovou složku hemoglobinu. Hem, který dává krvi její červenou barvu, je malá molekula (zhruba téže velikosti jako chlorochin a asi velikosti jedné třicetiny jednoho ze čtyř bílkovinných řetězců hemoglobinu), která se váže na protein, ale neskládá se z aminokyselin. Jde o nepoživatelný a jedovatý odpadní produkt, který musí parazit rychle neutralizovat. Nahromadí-li se hem v parazitově zažívacím ústrojí – jeho „žaludku“ – bacil zemře. Běžné je, že P. falciparum sváže hemový odpad tak, že vytvoří cosi, čemu říkáme hemozoin, který je neškodný. Chlorochin však narušuje toto odklízení odpadu, takže jedovatý hem zůstává volný. To, jak přesně hem parazita zabije, není zcela jasné. Odsouzení k utonutí ve svém vlastním odpadu je však příhodný konec pro příčinu tolikeré lidské bídy.
hemozoin = pigment obsahující železo, rozkladný produkt hemoglobinu hromadící se jako cytoplasmová granula v maláriových parazitech (pozn. překl.).
Aby chlorochin mohl zabít malárii, musí se dostat do parazitova „žaludku“ a chvíli tam zůstat. A vskutku, parazit sám sáhne po léku a zahustí ho ve své trávicí vakuole desettisíckrát. Proces je složitý a existuje mnoho způsobů, jak by se dal obejít, což propůjčí parazitovi odolnost vůči léku. Zaspekulujme si nyní o těchto možnostech, aniž bychom se již trápili mutační složitostí.
Snad by mohlo být trochu změněno prostředí trávicí vakuoly tak, aby bylo méně vhodné pro lék. Nebo by možná proteinová pumpa, která běžně odstraňuje z buňky jiné věci, mohla být trochu upravena tak, aby vylučovala jed. Či by třeba některá část běžného opravného aparátu buňky mohla být seštípnuta a zakroucena tak, aby chemicky poškodila chlorochin. Nebo by možná P. falciparum mohlo změnit některé ze složek své membrány, aby zamezilo vstupu chemikálie. Či by snad mohlo vyvinout jiný způsob zacházení s odpadem. Velké množství způsobů, jak může parazit zneškodňovat chlorochin, ztěžuje vědcům vystopování procesů, které opravdu probíhají při vytváření odolnosti na léky. Teprve v posledních několika letech se podařilo vědcům odhalit mutaci, která činí P. falciparum odolným vůči chlorochinu. Ani dnes si badatelé nejsou jisti, že znají celou pravdu, ale věří, že jde alespoň o velký kus pravdy.
Skupina vedená Thomasem Wellemsem z Národních ústavů zdraví učinila tenhle objev na základě série genetických studií parazita. Nejprve je omezili na pouhý jeden ze čtrnácti parazitových chromozomů. Rafinovanější (a pracnější) studie dále vymezily oblast obsahující gen odolnosti na úsek onoho chromozomu o čtyřechstechtisících nukleotidů (3), a pak ještě na úsek o šestatřicetitisících nukleotidů (4). Velmi pečlivá analýza podrobností téhle oblasti parazitovy genetické mapy objevila dříve nepovšimnutý gen.
Když nasekvenovali onen gen, byli pracovníci s to určit aminokyseliny v bílkovině, které hledali. Šlo o jehlu v kupce sena: jednu z přibližně pěti tisíc tří set bílkovin, které parazitova DNA kóduje (5). Pomocí pokroku, který biologie učinila v uplynulých několika desetiletích, jsou vědci schopni říci mnoho o tom, jakou roli bude asi hrát protein v buňce jen tak, že prohlédnou jeho sekvenci aminokyselin, dokonce ještě předtím, než provedou jakékoli pokusy. Naučili se rozeznávat vzorce v sekvencích aminokyselin, které s jistotou nalezneme v proteinech, které zastávají konkrétní úlohy v organizmu. Jako analogii můžeme uvést, že je to jako kdyby inženýr uviděl nezvyklý stroj, který má kola, a uhodl by z toho, že je patrně užíván k nějakému druhu dopravy; pokud by stroj měl ostrý nůž, je tato část patrně užívána k řezání něčeho; a tak dále.
Sekvence proteinu – přezdívaná PfCRT, což znamená rys odolnosti P. falciparum vůči chlorochinu – odhalila, že bílkovina obsahuje deset zvláštních oddílů aminokyselin, které jsou všechny hydrofobní (nerozpustné ve vodě) čili mastné. To naznačovalo, že v buňce budou tyto oddíly zapuštěny do membrány, která je sama tvořena mastnými molekulami, které dávají přednost styku s jinými mastnými molekulami. Ostatní oblasti PfCRT nebyly tak hydrofobní a patrně vyčnívaly do vody na jedné straně membrány či na druhé. Další bílkoviny, o nichž víme, že mají takovéto znaky, pomáhají tvořit pumpy či portály. Membrány všech živých buněk obsahují mnoho různých druhů bílkovinných aparátů, které fungují jako brány a umožňují takovým molekulám jako jsou živiny čili nutrienty vstupovat a odpadním produktům vystupovat. Brány jsou někdy pasivní a prostě umožňují molekulám se správným tvarem proplouvat na vlastní pěst. Často jsou však brány aktivní a sbírají správné molekuly a prostrkávají je membránou. Jelikož má buňka co dělat s mnoha různými druhy molekul, které procházejí oběma směry, má mnoho zvláštních pump a portálů.
ZMĚNA PUMPY
Sekvence aminokyselin u PfCRT naznačovala, že jde o proteinovou pumpu, ale bylo třeba tohle podezření potvrdit. Za použití chytrých laboratorních technik ukázali Wellems a jeho spolupracovníci, že bílkovina je umístěna v membráně parazitovy trávicí vakuoly – jeho žaludku. Díky téhle bílkovině shromažďují žaludky zmutovaných parazitů mnohem méně chlorochinu a bacil přežívá a rozmnožuje se. Proč přesně shromažďují žaludky mutantů méně léku není v současné době jasné, ale může to snadno být tak, že mutace způsobuje, že chlorochin vyteče skrze pumpu PfCRT (6).
Ohromující složitost moderní biologie je výzvou pro naši inteligenci, ale abychom našli hranici evoluce, musíme se dostat na její dno – a ještě tam tak docela nejsme. Protein PfCRT má 424 aminokyselin. Podobně jako srpkovitý hemoglobin vykazuje změnu ve sledu aminokyselin proti hemoglobinu normálnímu, zmutovaný PfCRT má také změny ve své sekvenci (7). A právě tak jako různé mutanty hemoglobinu nalézáme v různých oblastech světa (jako třeba HbC v Africe, HbE v Asii a talasemie kolem Středozemního moře), byly nalezeny různé mutace PfCRT z různých oblastí světa. Vědci analyzovali protein z P. falciparum od pacientů z Jižní Ameriky, Asie i Afriky. Mutantní proteiny PfCRT vykazují řadu změn postihujících nejméně čtyři a nejvýše osm aminokyselin. Téměř vždy jsou však přítomny dvě změny týchž aminokyselin – jedno přepnutí v poloze číslo 76 a další v poloze 220. Další mutace v proteinu se navzájem liší, přičemž jedna skupina mutací je společná parazitům odolným vůči chlorochinu z Jižní Ameriky a druhý trs mutací se objevuje u malárie z Asie a Afriky. To naznačuje, že odolnost vůči chlorochinu při malárii patrně vznikla přinejmenším dvakrát, samostatně v Jižní Americe a Asii, a že asijská odolnost byla přenesena do Afriky. Pozdější práce naznačovaly, že vlastně existují čtyři samostatné zdroje.
Protože se dvě konkrétní změny aminokyselin objevují téměř ve všech zmíněných případech, zdá se, že obě jsou třeba pro prvotní aktivitu, pomocí níž protein prokazuje odolnost. Mutace další zřejmě „kompenzují“ vedlejší účinky způsobené těmito dvěma prvotními mutacemi.

OBRÁZEK 3.1: Schématický nákres bílkoviny PfCRT. Každý kroužek představuje jednu polohu aminokyseliny. Šipky ukazují na černé kroužky, které představují dvě polohy (76 a 220), kde téměř vždy nacházíme u rezistentních proteinů mutace. (Reprodukováno z Bray, P. G., Martin, R. E., Tilley, L., Ward, S. A., Kirk, K., a Fidock, D. A. 2005. Definice role PfCRT v odolnosti Plasmodium falciparum vůči chlorochinu. Mol. Microbiol. 56: 323-33. Za laskavé svolení k otištění děkuji Blackwell Publishing.)
V poslední kapitole jsme viděli, že změny v lidských genech bezprostředně před útokem malárie byly omezeními – přínosné byly pouze za extrémních okolností, jinak v normálních dobách byly zhoubné. P. falciparum však ve svém počtu zdaleka převyšuje lidi a rozmnožuje se mnohem rychleji, a proto má daleko více příležitostí pro šťastné genetické náhody. Podle standardní darwinovské teorie by mělo plasmodium udělat příští krok v závodech ve zbrojení velmi záhy. Standardní darwinovská logika předpovídá, že malárie bude mutovat více a prověřovat své mutace účinněji než lidé. Takže představují změny ve zmutovaném PfCRT zlepšení? Sílí parazit v absolutním smyslu a rozvíjí nový „pokročilý a složitý aparát“, jak by snad očekával Richard Dawkins? Zdá se, že nikoli. Není-li totiž už chlorochin užíván k léčení malarických pacientů v určité oblasti, pak zmutovaný kmen P. falciparum ustupuje a vrací se tam kmen původní, což naznačuje, že mutant je slabší než původní kmen, v nepřítomnosti jedovatého chlorochinu (9). Zřejmě, stejně jako u lidské talasemie či srpkovitého hemoglobinu či nedostatku G6PD, je zmutovaný malarický protein výhodou pouze za zoufalých okolností – v zákopové válce.
TYGRA ZA OCAS
V době dospívání jsem byl velkým fanouškem vědeckofantastické literatury a pamatuji se, že jsem četl povídku s názvem „Tygra za ocas“ (10). V oné povídce se otvor do jiného rozměru nějak vynořil v …kabelce! Kdosi pak měl výborný nápad vyhodit skrze otvor kotvu. Pokud by kotva vytáhla hmotu z jiné dimenze do naší či opačně, pak by byl rozměr, který ztratil vlečný řetěz války, zničen. (Po ruce byl hned vědec, aby to vše vysvětlil). Tohle, myslili si lidé, je výborná cesta k vydírání cizinců na druhé straně. Na konci povídky však řetěz držící kotvu, který se pomalu vynořoval z kabelky, obrátil směr, když cizinci více zatáhli za svůj konec. Karta se obrátila a teď bylo ohroženo veškeré lidstvo.
V téhle povídce je analogie k boji lidstva s malárií. Malarický parazit se také staví na odpor a opírá se do kotvy syntetických léků. Chlorochin byl v mnoha ohledech pohádkovým lékem – nejen účinný, nýbrž i levný a s málem vedlejších účinků. Trvalo celá desetiletí, než se odolnost vůči němu rozšířila. Novější léky a metody v boji proti malárii postrádají jeden či více těchto rysů. Nejenže je malárie téměř úplně odolná vůči chlorochinu, ale stává se ve zvýšené míře schopnou bránit se vůči novějším lékům, které následovaly. Zdá se, že malárie, která vyvinula odolnost vůči jednomu léku, vyvíjí odolnost vůči novým lékům zvýšenou rychlostí ve srovnání s malárií „původní“ (11). Dodatek B se zabývá konkrétními podrobnostmi několika kol této zákopové války.
Rozvoj lékové rezistence u malárie je podobně jako vznik genu srpkovité krvinky a talasemie u lidí krystalicky jasným příkladem darwinovské evoluce v akci. Vidíme ji zde v plné kráse – selekční tlak vyvíjený na malárii toxickými léky, občasné mutace, které činí jeden bacil zdatnějším než jsou jeho příbuzní, rozšíření mutace v populaci. Avšak malárie krásně ilustruje jak silné stránky tak slabiny onoho druhu slepého hledání, který darwinovská evoluce vyžaduje. A pomocí matematiky můžeme konečně začít dosahovat určité míry jemného vystižení mezí náhodných mutací.
Otázka: Co je to srpkovitý hemoglobin?
Odpověď: Překážka tomu, aby malárie byla schopna stále mutovat.
V našem závistivém obdivu nad magií P. falciparum, se kterou se rychlými mutacemi vyhýbá našim zázračným lékům (i když jsou tyhle změny vposledku ztrátami), je snadné pustit ze zřetele jeho neschopnost vyrovnat se se srpkovitým hemoglobinem. Srpek je na světě tisíce let, nikoli pouhá desetiletí jako antimalarické léky. Odolnost vůči jednomu novému léku, atovaquonu, se objevila v laboratoři sotva pár týdnů po tom, co mu byla vystavena malá kultura malárie. Téměř stotisíckrát tolik času uplynulo od okamžiku, kdy se narodila Eva se srpky. A zhruba stejně tolik času uplynulo také od doby, kdy žila Eva C, a od doby, kdy se poprvé objevila talasemie. A přece je tohle všechno stále proti malárii účinné.
atovaquon = antiprotozoikum, užívá se proti pneumocystóze, malárii, toxoplasmóze. (pozn. překl.)
Jak k tomu může docházet? Proč by měla jediná změna aminokyseliny u srpkovitého hemoglobinu dávat mat malarické smrti vraždící miliony, když s nejlepšími rozumovými snahami chemiků malárie tak snadno zamete? Je odpovědí složitost chemikálie? Ne. Chlorochin není méně složitý než nová aminokyselina v srpkovitém hemoglobinu. Jde o specificitu cíle? Ne. Problémy, které způsobuje chlorochin, nejsou méně specificky zaměřeny na žaludek parazita než problémy, které vytváří v červené krvince srpek; naopak, chlorochin je specifičtější. Jde o nezkušenost parazita v tom, jak se vyrovnat s oblastí útoku? Sotva. Parazit běžně jí hemoglobin; je uzpůsoben k zacházení s touto látkou. Chlorochin je umělá chemikálie. Malárie před 30. lety 20. století nikdy tento lék neviděla. A přesto parazit zdolal chlorochin, ale je zmaten srpkem.
K důvodu, proč je srpek takovou výzvou, se ještě dostanu. V tomto okamžiku si jenom dobře všimněme jednoho mimořádně důležitého důsledku širokého rozpětí úspěchu resp. neúspěchu malárie při vyrovnávání se s výzvami, které ji potkávají. Jeden prostý, ale zásadní závěr, který můžeme již učinit, je tento:
Darwinovská evoluce se dokáže vyrovnat rychle a snadno s určitými problémy, ale s jinými jí to jde pomalu, pokud na ně vůbec stačí.
Existují problémy, které jsou ještě těžší pro evoluci než vyrovnat se se srpkovitým hemoglobinem? Problémy, které jsou podle všeho mimo dosah náhodné mutace?
LOTERIE POWERBALL
Téměř každé pondělí večer chodíme se ženou do sportovního baru několik mil od domova, abychom spolu strávili několik hodin o samotě, bez dětí. (Bar Buffalo wings účtuje v pondělí večer poloviční ceny.) Při cestě tam se obyčejně zastavím v nejbližším supermarketu, abych si koupil sázenku loterie Powerball. Jistě nebude dlouho trvat a vyhraji jackpot, ale dosud se mi nepodařilo trefit více než jediné číslo na jedné sázence. Smolař od narození.
V kombinované loterii Powerball („silný míček“) je taženo pět bílých míčků z osudí, které obsahuje padesáttři postupně číslovaných míčků a pak jeden (bájný Powerball sám) ze zvláštní nádoby s dvaačtyřiceti červenými míčky. Sázenka má pět čísel seřazených společně, a pak číslo zvláštní. Existují různé cesty, jak vyhrát cenu. Pokud se zvláštní číslo na Vaší sázence shoduje s Powerballem, dostanete tři dolary. Shodují-li se číslo Powerballu a jedno další, jste na čtyřech dolarech. Abyste vyhráli hlavní cenu (nejméně deset milionů dolarů), musí se shodovat všechna čísla.
Šance na výhru hlavní ceny je oficiálně vyčíslena jako jedna ku 120 526 770. Šance na výhru menších cen jsou lepší: jedna ku 260 pro uhodnutí třech bílých míčků, jedna ku 12 248 pro uhodnutí čtyř bílých míčků, jedna ku 2 939 677 pro uhodnutí pěti bílých míčků. Nepřekvapí, že šance vyhrát se zhoršují s tím, kolik míčků musíte uhodnout, a zhoršují se rychle. Uhodnout čtyři míčky není jenom, řekněme, o 33 procent těžší než uhodnout tři – je to asi padesátkrát těžší. Uhodnout pět míčků je mnohosetkrát méně pravděpodobné než uhodnout čtyři, a desettisíckrát méně pravděpodobné než uhodnout tři.
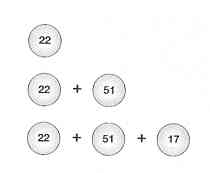
OBRÁZEK 3.2: Pravděpodobnost, že nevyhrajete v loterii jako je Powerball, rychle stoupá s tím, kolik čísel máte uhodnout. Tatáž zásada platí pro mutace v DNA.
Často při tahu Powerballu nikdo jackpot nevyhraje, protože si nikdo nekoupil sázenku, na níž by vyplnil vítězná čísla. Stane-li se to, jsou nahromaděné peníze přesunuty do další hry a jackpot pro další tah je o to vyšší. Jak dlouho asi potrvá, než někdo (nikoli určitá osoba, prostě kdokoli) vyhraje velkou cenu? Kromě šancí na trefu správných čísel závisí tahle doba na dvou dalších věcech – počtu hráčů a frekvenci tahů. Jsou-li šance na výhru jedna ku sto milionům, a pokud pokaždé hraje milion lidí, pak bude trvat průměrně asi sto tahů, než někdo vyhraje. Takže jsou-li dva tahy týdně (asi sto ročně), pak potrvá asi rok, než někdo vyhraje. Kdyby se však losovalo jen jednou ročně, trvalo by průměrně celé století, než by někdo vyhrál jackpot. Kdyby se změnil počet hráčů, změnila by se i průměrná doba, než by se našel výherce. Kdyby hrálo pokaždé deset milionů lidí místo jednoho milionu, pak by bylo průměrně třeba jen deset tahů na výhru. Pokud by pokaždé hrála miliarda lidí, pak by bylo velmi pravděpodobné, že při každém tahu by bylo několik vítězů.
Naprosto stejné tři prosté úvahy, které určují, jak často někdo vyhraje v loterii Powerball – šance na uhodnutí správných čísel, počet hráčů a jak často je loterie pořádána – také určují, jak rychle si malárie získá rezistenci vůči antibiotiku. Právě tak, jako šance na výhru v Powerballu závisí na rozsahu možných čísel (1 až 53) a na tom, kolik míčků máte uhodnout, šance na získání odolnosti vůči antibiotiku závisí na počtu nukleotidů v genomu parazita (miliony) a na tom, kolik mutací se musí nahromadit, než dojde k přínosnému efektu. Právě tak, jako doba uplynulá než se najde vítěz závisí na tom, jak často je loterie pořádána, doba potřebná k vytvoření odolnosti u P. falciparum závisí na četnosti mutací v organizmu a na intervalu generací. A právě tak, jako je doba k jackpotu tím kratší, čím více lidí hraje Powerball, je doba k antibiotické rezistenci tím kratší, čím více malarických parazitů je vystaveno léku.
NA DORAZ
Vědci zabývající se malárií jsou si naléhavě vědomi těchto faktorů a zohledňují je při plánování boje s parazitem. Jeden tým badatelů poznamenává, že „pohoda, s níž populace parazitů přežívá vystavení léku, závisí na …frekvenci, s níž parazité vyvíjejí odolnost…a na velikosti parazití populace na začátku léčby“ (12). Například pokud je šance, že buňka bude odolná na daný lék, jedna ku milionu, a je-li v pacientovi sto milionů parazitických buněk, pak téměř jistě budou v pacientovi i nějaké buňky rezistentní. Podání léku zabije 99.9999 procent buněk, které jsou citlivé, ale přibližně sto rezistentních buněk přežije a rozmnoží se. Brzy bude pacient plný odolných buněk.
Jsou-li šance na rezistenci vůči jinému léku jedna ku miliardě, pak je dobrá pravděpodobnost, že osoba trpící malárií, která má pouze sto milionů parazitických buněk, bude tímto lékem vyléčena, neboť lék patrně zabije všechny škodlivé buňky. Avšak pokud má deset lidí každý sto milionů buněk, pak dohromady zde máme miliardu buněk P. falciparum, a je stejná šance, že jedna z oněch buněk u jednoho z oněch pacientů bude odolná. Léčí-li klinika sto takových pacientů za den, pak bude mít průměrně jeden z každých deseti oněch pacientů odolnou buňku. Budou-li tito pacienti léčeni, rezistentní buňky přežijí a rozmnoží se, pacienty štípne komár, a komáři rozšíří rezistentní buňky na další lidi. V krátké době bude lék nepoužitelný.
Abychom značně zvýšili šance na úspěšnou léčbu, jednou ze strategií je užít celý koktejl léků, z nichž každá složka je schopna zabít poměrně velký trs buněk. Například, když naléhal, aby se užilo zároveň několik léků proti malárii, jeden badatel vysvětloval:
Odolnost vůči antimalarickým lékům vzniká tehdy, jsou-li vybráni a pak se rozšíří spontánně vzniklí mutanti…kteří prokazují omezenou citlivost vůči léku. Současné užití dvou či více antimalarik…omezí šanci na výběr, protože pravděpodobnost přežití rezistentního mutanta je produktem rychlostí mutace parazita na konkrétní léky, násobenou počtem parazitů v infekci, kteří jsou vystaveni lékům (13).
Řekněme, že koktejl obsahuje dva léky, A a B, a že jedna z milionu parazitických buněk je odolná vůči léku A, a jedna z milionu vůči léku B. Předpokládáme-li, že rezistence vůči A je způsobena jinou mutací než rezistence vůči B, pak je pravděpodobnost, že jediná konkrétní buňka je rezistentní na oba léky v téže době, znásobena, milionkrát milion, což činí jedna ku bilionu.
Ve skutečném pokusu zahrnujícím tenhle základní princip ukázali vědci z katolické univerzity ve Washingtonu, D. C., že odolnost vůči jednomu léku (zvanému 5-fluororotat) v jisté koncentraci byla nalezena v malarických buňkách s četností asi jedna ku milionu. Odolnost vůči druhému léku (atovaquonu) byla asi jedna ku sto tisícům. A opravdu, odolnost vůči oběma lékům se rovnala vynásobeným pravděpodobnostem pro ony dva případy, tedy asi jedna ku stotisíc krát milion, tj. jedna ku stu miliardám.
Použití kombinace léků je běžnou strategií k oddálení nástupu odolnosti. Kromě boje s malárií jsou lékové koktejly užívány například k boji proti AIDS a tuberkulóze. Oddálení nástupu odolnosti není však totéž jako její úplné zastavení. Badatelé z katolické univerzity varovali, že i když kombinace léků, kterou testovali, patrně vyléčí kteroukoli danou osobu (jelikož pravděpodobnost, že osoba bude mít odolný bacil, je malá), „dost velká populace pacientů nevyhnutelně umožní selekci parazitů, kteří jsou odolní vůči oběma složkám.“ (14)
DVA ZA CENU JEDNOHO
Řekněme, že P. falciparum potřebovalo několik samostatných mutací k tomu, aby se vypořádalo s pouhým jedním antimalarickým lékem. Předpokládejme, že nestačila změna jedné aminokyseliny. Řekněme, že se musely změnit dvě různé aminokyseliny, než se projevil přínosný efekt pro parazita. V tomto případě bychom měli situaci velmi podobnou koktejlu s kombinací léků, ale pouze s lékem jedním. Tj., pravděpodobnost určité buňky P. falciparum, že bude mít několik potřebných změn, by byla mnohem, mnohem menší než případ, kdy potřebovala změnit jenom jednu aminokyselinu. Tenhle faktor je zdá se tajemstvím toho, proč byl chlorochin po desetiletí účinným lékem.
Oč těžší je to pro malárii vyvinout rezistenci vůči chlorochinu než vůči některým jiným lékům? Při odpovědi se můžeme dobře opřít o to, obrátíme-li logiku a zjistíme-li počet malarických buněk potřebných k nalezení jedné, která je imunní vůči léku. Například v případě atovaquonu prokázala klinická studie, že asi jedna z bilionu buněk měla spontánní rezistenci (15). V jiném pokusu se prokázalo, že jediná mutace aminokyseliny, způsobující změnu na pozici číslo 268 v jediném proteinu, stačila na to, aby bylo P. falciparum odolné vůči tomuto léku. Takže můžeme vyvodit, že pravděpodobnost získání oné jediné mutace je přibližně jedna ku bilionu. Na druhé straně, rezistence vůči chlorochinu se objevila méně než desetkrát na celém světě v uplynulém půlstoletí. Nicholas White z univerzity Mahidol v Thajsku zdůrazňuje, že vynásobíte-li počet parazitů u osoby, která je velmi nemocná malárií krát počet lidí, kteří každoročně dostanou malárii krát počet let od zavedení chlorochinu, pak můžete odhadnout, že pravděpodobnost, že parazit vyvine rezistenci vůči chlorochinu, je zhruba jedna ku sto miliardám miliard (16). Ve zkrácené vědecké notaci je to jedna ku 10 na 20.
BOX 3.1
Vědecký zápis
Vědci mají často co do činění s čísly, která jsou velmi velká (řekněme počet hvězd ve vesmíru) či velmi malá (řekněme hmotnost protonu). Aby to měli pohodlné, mohou používat vědecký zápis. Ve vědeckém zápisu napíšeme desítku a počet nul v čísle vyjádříme horním indexem vpravo od ní. Například místo čísel 10, 100 a 1000, napíšeme 10^1, 10^2, a 10^3. Místo vypisování velkého čísla jako je bilion, 1 000 000 000 000, ve vědecké notaci je bilion zapsán prostě jako 1012, což se lépe čte a šetří to místo. Musíme si zapamatovat, že počty rostou velmi, velmi rychle s tím, jak roste index (zvaný též exponent). Srovnejte například čísla 10^4 a 10^10. Na první pohled se snad nezdají tak rozdílná. Avšak dělník s minimální mzdou vydělá asi 10^4 (desettisíc) dolarů za rok; jen někdo jako Bill Gates může vydělat 10^10 (deset miliard) dolarů za rok. Rozdíl pouhých šesti mezi desítkou a čtyřkou v exponentech znamená, že čísla se liší milionkrát. Níže uvedená tabulka ukazuje žebříček s čísly napsanými jak v běžné tak ve vědeckém zápisu, a příslušné počty obyvatel či populací, abyste si utvořili o věcech představu.
10^12 = 1 000 000 000 000 = populace malarických buněk u jedné nemocné osoby
10^9 = 1 000 000 000 = počet obyvatel Číny
10^6 = 1 000 000 = počet obyvatel Philadelphie, Pennsylvanie
10^3 = 1 000 = počet obyvatel Hellertownu, Pennsylvanie
10^0 = 1 = Vy
SROVNÁVÁNÍ DVOU
Srovnejme ona dvě čísla pro pravděpodobnost získání odolnosti vůči atovaquonu, kde je třeba jen jedna mutace, a vůči chlorochinu, kde (patrně – jelikož pokud by mohla pomoci jediná mutace, odolnost vůči chlorochinu by vznikala mnohem častěji) jsou potřeba dvě. Pravděpodobnost je jedna ku bilionu (10^12) respektive jedna ku stu miliardám miliard (10^20). Rozdíl těchto dvou čísel ukazuje, že malarický parazit vyvine rezistenci stomilionkrát (10^8) méně pravděpodobně na chlorochin než na atovaquon. To je důvěryhodné, protože velikost genomu malarického parazita je přibližně sto milionů nukleotidů. Vyplývá z toho, že musí-li se změnit dvě aminokyseliny v proteinu místo pouhé jediné, snižuje to pravděpodobnost odolnosti asi stomilionkrát.
I když se pravděpodobnost staví nemilosrdně proti, bylo P. falciparum schopno vyvinout chlorochinovou rezistenci, protože existuje enormní počet parazitických buněk (asi bilion) v těle nakaženého pacienta a asi miliarda nakažených lidí ve světě za rok. Takže parazitovi hrají do karet počty populací proti hrozivé pravděpodobnosti. Spontánní rezistenci vůči atovaquonu můžeme nalézt u zhruba každé třetí nemocné osoby (17). Se spontánní rezistencí na chlorochin se setkáváme asi u jedné osoby z miliardy, a jelikož se vyskytuje obvykle skoro miliarda nemocných lidí na planetě každý rok, znamená to, že odolnost vůči chlorochinu se obvykle vyskytne přinejmenším u jedné osoby někde ve světě v jakoukoli dobu.
MÉNĚ HRÁČŮ, DELŠÍ DOBA
Předpokládejme, že P. falciparum by nebylo zdaleka tak úžasně úspěšné jako ve skutečnosti je. Co kdyby bylo místo bilionu malarických buněk u typické nemocné osoby jen buněk milion? Jak dlouho by pak trvalo chlorochinové rezistenci, než by se vynořila? Kdyby všechny ostatní podmínky zůstaly zachovány, trvalo by to asi milion let. Důvodem je skutečnost, že kdyby existovalo méně parazitů na osobu a tedy méně ve světové populaci, pak by parazit musel čekat proporcionálně delší dobu, než by se vyskytla správná kombinace mutací. Počet hráčů v loterii by klesl milionkrát, takže by milionkrát vzrostla doba potřebná k získání výherce.
Tento přímočarý příklad nese s sebou jeden zřejmý důsledek. Druhům, které vykazují méně živých organizmů než malárie (opět za podmínky, že vše ostatní zůstává stejné), bude trvat proporcionálně déle, než vyvinou klastr mutací o stejné složitosti, jakou má rezistence malárie na chlorochin. Nazvěme mutační klastry onoho stupně složitosti – 1 ku 10^20 – „klastry chlorochinové složitosti“, čili CCC. Je jasné, že jelikož je malárie mikrob, její populace je nesrovnatelně četnější než populace jakéhokoli zvířete či rostliny, které můžeme vidět neozbrojeným okem. Prakticky všem nemikroskopickým druhům bude trvat déle – možná mnohem, mnohem déle – než vytvoří CCC, na rozdíl od těch pár let, za něž to stihla malárie, nebo těch pár desetiletí, která trvalo chlorochinové mutaci, než se masově rozšířila.
Vezměte si druh, který je drahý našim srdcím – Homo sapiens. Počet lidských hráčů ve světě je mnohem menší než 10^20. Předpokládá se, že po většinu z uplynulých deseti milionů let čítala jedna populace oné linie primátů, která vedla k člověku, přinejlepším zhruba asi milion jedinců (18). Pouze v uplynulých pár tisících let tento počet vzrůstal až na dnešní populaci 6 miliard.
Jaký je celkový počet tvorů v linii vedoucí k lidem od doby, kdy se oddělila od linie vedoucí k moderním šimpanzům před méně než deseti miliony let? Zaokrouhlíme-li průměrné generační rozpětí humanoidů umírněně dolů, na asi deset let, pak velkorysý odhad je, že nás v uplynulých deseti milionech let předcházelo snad bilion tvorů (19). Ačkoli je to hodně, je to stále mnohem, mnohem méně než činí počet malarických parazitů potřebných k vyvinutí chlorochinové rezistence. Poměr humanoidních tvorů v uplynulých deseti milionech let k počtu parazitů potřebných pro chlorochinovou rezistenci je jedna ku stu milionům.
Točí-li se Vám ze všech těch obrovských čísel hlava, vezměte to takhle. Pravděpodobnost, že Homo sapiens dosáhl jakékoli jediné mutace toho druhu, který je třeba pro malárii, aby se stala odolnou vůči chlorochinu – abychom si rozuměli, nikoli té nejsnadnější mutace, ale přece pořád jen posunu dvou aminokyselin – , pravděpodobnost, že by taková mutace mohla vzniknout byť jen jedinkrát v celých dějinách lidského rodu v uplynulých deseti milionech let, je nepatrná – téhož řádu jako, řekněme, pravděpodobnost, že byste Vy osobně vyhráli loterii Powerball zakoupením jediné sázenky.
Aby lidé dosáhli takové mutace náhodou, museli bychom čekat průměrně stomilionkrát deset milionů let. Jelikož to mnohokrát přesahuje věk vesmíru, je rozumné uzavřít celý problém takto: Žádná mutace, která je stejně složitá jako malarická rezistence vůči chlorochinu, nevznikla darwinovskou evolucí v linii vedoucí k člověku v uplynulých deseti milionech let.
Místo abychom se soustředili na nás lidi, můžeme se podívat na šance jiným způsobem. Existuje asi pět tisíc druhů moderních savců. Pokud by měl každý druh v průměru milion členů, (20) a pokud by se každý rok objevila nová generace, a pokud by tohle vše probíhalo dvě stě milionů let (21), pravděpodobnost objevení jediné CCC v celé skupině zvířat za celý ten čas by byla pouze jedna ku stu.
Zapamatujme si to na chvíli. O savcích se soudí, že vznikli z plazů, a pak se rozrůznili do úžasně široké řady tvorů, včetně netopýrů, velryb, klokanů i slonů. Ale očekávali bychom, že tenhle celý proces – došlo-li k němu darwinovskými mechanizmy – proběhl bez jediné přínosné mutace o složitosti CCC. Přísný darwinizmus od nás žádá víru v to, že k evoluci savců mohlo dojít bez jediné takto složité mutace.
Zde narážíme na možný sporný bod. Odhadli jsme pravděpodobnost CCC – jedna ku stu miliard miliard (10^20) – podle počtu malarických parazitů potřebných k vývoji dvojité mutace určitého proteinu určitého genu. Někdo by mohl namítnout, že jelikož v organizmu existují tisíce jiných proteinů, mnoho další DNA a mnoho dalších druhů mutací než pouhé změny aminokyselin, nejsou pak šance pro nalezení nějakého přínosného komplexu mutací mnohem vyšší než šance na nalezení právě onoho specifického komplexu mutací, který jsme izolovali?
Nikoli. Mnoho, mnoho mutací kromě těch, které jsme probírali, se vynořilo náhodou v obrovském světovém malarickém fondu během několika let. Opravdu, můžeme předpokládat, že mutace na všech aminokyselinových pozicích všech malarických proteinů – chápáno na obou zároveň – se objeví náhodou během téže doby. A jiné typy mutací kromě pouhých změn aminokyselin se také objevují (třeba inzerce, delece, inverze, duplikace genů, mobilní transpozice DNA, změny v regulačních oblastech i jiné, snad dokonce včetně celkového zdvojení genomu – některé z těchto typů mutací probereme v následující kapitole). Ačkoli se vědci domnívají, že některé jiné mutace v některých jiných proteinech přispěly k chlorochinové rezistenci (22), žádná není ani zdaleka tak účinná jako mutace v PfCRT. To znamená, že ze všech možných mutací ve všech rozličných proteinech malárie, jen nepatrné množství z nich má schopnost pomoci proti chlorochinu, a jenom jedna, PfCRT, je opravdu účinná. Přírodní výběr umí vybírat z úžasného počtu variací, ale pomáhá jich přinejlepším jen hrstka. Takže CCC není pouze šancí určité bílkoviny získat správné mutace; je to pravděpodobnost pro celý účinný klastr mutací, že v celém organizmu vznikne.
JEŠTĚ HORŠÍ
Vytvoření odolnosti vůči chlorochinu není nejtvrdším oříškem, který musí evoluce rozlousknout. Víme to jistě, protože malarický parazit onen problém vyřešil, ale nevyřešil jiné, jako třeba srpkovitý hemoglobin. Čím obtížnější než CCC bude muset úkol být, než bude darwinovská evoluce v zásadě neúčinná, i v případě jednoduchých jednobuněčných tvorů, jako je malárie?
Nejprve o tom uvažujte takto. Co kdyby, aby vyhrál loterii super-Powerball, někdo musel místo všech čísel na jedné sázence uhodnout všechna čísla na dvou sázenkách? Pravděpodobnost, že se tak stane, by se rovnala přibližně druhé mocnině šance na uhodnutí čísel na jedné sázence, přibližně sto milionům na druhou. Kdyby tomu tak bylo, pak (kdyby další podmínky zůstávaly stejné) by trvalo miliony let, než by vůbec někdo loterii vyhrál.
Vzpomeňte si, že pravděpodobnost nezískání dvou nutných, nezávislých mutací se rovná znásobené šanci na vytvoření každé z mutací individuálně. Co kdyby se během vývoje života na zemi vynořil problém, který by vyžadoval klastr mutací, který by byl dvakrát složitější než CCC? (Nazvěme ho dvojitým CCC). Například, co kdyby místo několika změn aminokyselin potřebných pro chlorochinovou rezistenci u malárie jich bylo potřeba dvojnásobné množství? V tom případě by pravděpodobnost byla dvojnásobkem pravděpodobnosti pro CCC. Místo 10^20 buněk k vyřešení evolučního problému bychom potřebovali 10^40 buněk.
Pracovníci univerzity státu Georgia odhadli, že asi miliarda miliard bilionů (10^30) bakteriálních buněk se vytvoří na zemi každičkým rokem (23). (Bakterie jsou zdaleka nejpočetnějším typem organizmů na zemi.) Kdyby tento počet byl konstantní po celou historii světa trvající několik miliard let, pak by během této doby existovalo o něco méně než 10^40 buněk, trochu méně než bychom potřebovali, abychom dosáhli dvojitého CCC. Závěr je tedy ten, že šance jsou mírně v neprospěch toho, že by se objevilo i jen jedno dvojité CCC pomocí darwinovských procesů v průběhu vývoje života na zemi.
Řečeno jasněji, dvojité CCC je přijatelným východiskem ke stanovení hypotetické čáry vyznačující hranici evoluce pro veškerý život na zemi. Nelze očekávat, že by k takové události došlo u jakéhokoli organizmu, který kdy žil po celou historii života na téhle planetě. Takže nalézáme-li přece rysy života, které by byly vyžadovaly dvojité CCC či více, pak můžeme dovodit, že zřejmě nevznikly darwinovským procesem.
Jak uvidíme, život takovými rysy oplývá.
VYMEZENÍ ROZDÍLŮ
Ušli jsme dlouhou cestu na omezeném prostoru načrtáváním důsledků dlouhé zákopové opotřebovávací války mezi lidstvem a malárií. Snad jsme se však pohybovali příliš rychle. Přes své omezené zdroje má darwinovská evoluce mnoho triků v rukávu, triků, které snadno přehlédneme, nejsme-li pozorní. Abychom byli co nejzasvěcenější jak to jen jde při vymezování čáry značící hranici darwinovské evoluce, potřebujeme důkladně zhodnotit cesty, jimiž se mohou ubírat náhodné mutace. V příští kapitole podáme přehled o nástrojích, které má evoluce k dispozici, a prozkoumáme příklady jejího působení.
4. Kapitola: Co darwinizmus zvládne
PŮVOD ZE SPOLEČNÉHO PŘEDKA VERSUS NÁHODNÁ MUTACE
„Jak jsem hloupý, že jsem na to nepomyslel!“ Tak naříkal přírodovědec Thomas Huxley, když poprvé slyšel o Darwinově teorii evoluce. I když tahle teorie snad nevysvětluje veškeré problémy biologie, od okamžiku, kdy byla roku 1859 zveřejněna, uznali všichni biologové, že přece jen velkou část vysvětluje. V této kapitole se zaměříme na to, co může být jednoznačně Darwinovou teorií vysvětleno.
Mějte vždy na paměti, že původ ze společného předka je jiný pojem než mechanizmus přírodního výběru pracující s náhodnou mutací. Není vždy snadné to rozlišovat. V praxi, nebudete-li pozorní, je snadné zaměnit efekty původu ze společného předka za efekty přírodního výběru. A opravdu je to tak snadné, že i sám Darwin je směšoval. Ernst Mayr píše:
To, že Darwinovi komentátoři hovoří nicméně téměř jednohlasně o kombinaci těchto různých teorií jako o „Darwinově teorii“ v singuláru, je zčásti vinou Darwina samotného. Nejenže mluvil o teorii evoluce vývojem ze společného předka jako o „své teorii“, nýbrž nazýval též teorii evoluce přírodním výběrem „svou teorií“ jako by původ ze společného předka i přírodní výběr byly teorií jedinou…[Darwin] připisoval mnohé jevy, zejména princip zeměpisného rozdělení, přírodnímu výběru, zatímco byly ve skutečnosti důsledkem původu ze společného předka (1).
Abychom vystihli hranice evoluce, musíme se snažit tyto dva principy rozlišovat. Ačkoli zákopová válka lidí s malárií ukazuje, že náhodná mutace je přísně omezena co do rozsahu, myšlenka původu ze společného předka přináší mnohem více pokroku.
Rodokmen je často tím aspektem Darwinovy mnohostranné teorie, který je nejvíce zdůrazňován. Například v poslední větě Původu druhů udeřil Darwin na lyrickou strunu.
„Je určitá velkolepost v tomto pojetí života, s jeho několika silami, které původně Stvořitel vdechl do několika málo tvarů či do jednoho; a v tom, že, zatímco tahle planeta rotuje dále podle neměnného zákona přitažlivosti, se z tak jednoduchého počátku vyvinuly a stále vyvíjejí nejkrásnější a nejúžasnější nekonečné tvary“ (2).
V několika dalších pasážích ukážu některé z nejnovějších důkazů ze studií DNA, které přesvědčují většinu vědců včetně mne o tom, že jeden pilíř Darwinovy teorie – původ ze společného předka – je správný. Začněme pohledem na něco, o čem Darwin neměl tušení – genetický základ života, a jak se může měnit.
PŘEHLÍDKA ROZMANITOSTI
V Původu druhů Darwin předpokládal, že přírodní výběr působí rozdílně v živém světě, že odměňuje schopnější a vyhlazuje méně schopné. V jeho době byl základ pro tyto rozdíly uvnitř druhu neznámý. Darwin musel prostě předpokládat, že existuje nějaký mechanizmus neznámý vědcům jeho doby, který je příčinou rozdílů.
Jedním z největších triumfů vědy dvacátého století byl objev základu biologické dědičnosti. V klasickém experimentu ve 40. letech 20. století prokázal Oswald Avery, že DNA je nositelkou genetické informace. Watson a Crick rozluštili elegantní dvoušroubovicovitý tvar této molekuly. Marshall Nirenberg rozluštil její genetický kód.
Watson, James D. (nar. 1928): americký biofyzik, který spolu s britským biofyzikem F.H.C.Crickem (nar. 1916) pomocí rtg difrakce popsal molekulární struktury DNA a způsob duplikace molekul DNA, genů a chromozomů (Nobelova cena 1962). (pozn. překl.)
Avery, Oswald Theodore (1877 – 1955): kanadský bakteriolog. Potvrdil aktivní úlohu DNA v buňce (1944). Považován za spoluzakladatele imunochemie a moderní molekulární genetiky. (pozn. překl.)
Nirenberg, Marshall Warren, amer. biochemik. Narozen 10. 4. 1927 v New Yorku. Práce na poli molekulární genetiky; měl vedle H.G.Khorana a R.W.Holeye (ale nezávisle na nich) zásadní podíl na objasnění genetického kódu; obdržel spolu s nimi r.1968 Nobelovu cenu za medicínu a fyziologii. (pozn. překl.).
Později vyvinuli vědci metody pro klonování, syntézu i sekvenování DNA. V červnu 2000 společně oznámili prezident USA Clinton a předseda vlády Velké Británie Tony Blair dokončení sekvenování lidského genomu. Toto oznámení znamenalo bezprecedentní mezník v rozvoji lidských intelektuálních možností. Byla to však pouze zastávka, nikoli konec, na cestě zkoumání základů života na zemi. Od té doby byly sekvenovány genomy stovek jiných organizmů a tisíce dalších jsou plánovány. Většinu těchto organizmů tvoří jednobuněčné mikroby, jejichž genomy jsou mnohem menší (asi tisíckrát) než genomy zvířat jako jsme my. Byly však sekvenovány i genomy některých větších rostlin i zvířat, včetně genomů šimpanze, psa, dánia pruhovaného a rýže.
Rychle přibývající data z projektů sekvenování genomu umožnila vědcům podívat se na mnoho různých způsobů, které mohou změnit DNA. Jinými slovy, teprve v posledních dekádách jsme schopni zkoumat ty druhy variací – mutace – , které se mohou vynořit v genomu. Buněčný proces, který kopíruje DNA, je neobyčejně věrný. U lidí a jiných vícebuněčných organizmů udělá zhruba jednu chybu na každých sto milionů nukleotidů DNA, které kopíruje v jedné generaci. Avšak jelikož počet nukleotidů v genomu jedné buňky se pohybuje v řádu milionů až miliard, na buňku připadá vlastně dost chyb.
Průměrně, v závislosti na druhu organizmu a na tom, kolik DNA má, dochází k mutaci v poměru od zhruba jedné mutace na každou stovku buněk po deset mutací na buňku. Kdyby DNA odpovídala přesně detailnímu plánu, bez prázdných míst, a každá linka a křivka by reprezentovala bod budovy, pak by byla tahle četnost mutací osudová.
Koneckonců, jedna kritická chyba stačí k zabití organizmu (či způsobení zřícení budovy). Ale ve skutečnosti nepředstavuje DNA přesně detailní plán. Jen zlomek jejích úseků se přímo účastní tvorby bílkovin a stavby života. Zdá se, že většina z ní je přebytečná DNA, kde jsou vyskytnuvší se mutace neškodné.
Mutací je několik druhů. Když byla počata Eva se srpky, jedna kopie úseku DNA, který sloužil jako plán pro beta řetězec jejího hemoglobinu, byla změněna, takže byla jediná aminokyselina zaměněna za jinou. Nepřekvapí, že tohle nazýváme substituční mutací – přímým přepnutím, kdy jediné písmeno z miliard písmen v DNA je vyměněno za jiné. Výměna jediného písmene vede často ke změně v sekvenci aminokyselin k výrobě bílkovin, jak tomu bylo u Evy se srpky, ale ne vždycky (3).
Existují také další druhy mutací. Jednu skupinu nazýváme mutace deleční. Jak už název napovídá, k delečním mutacím dochází tehdy, když je část DNA sahající od jediného písmene k velkému trsu genomu náhodně vypuštěna, když je DNA zdvojována. Někteří lidé mají například vypuštěno dvaatřicet nukleotidů (písmen) v genu pro bílkovinu zvanou CCR5. Požehnáním je, že zmutovaný gen umožňuje ochranu před HIV, virem způsobujícím AIDS u lidí. Opakem deleční mutace je inzertní mutace. K té dochází, když je nadbytečná DNA náhodně vsunuta do určité oblasti. Lidé trpící Huntingtonovou nemocí (jako třeba folkový zpěvák 30. let 20. století Woody Guthrie) mají četné nadbytečné kopie jistého segmentu tří nukleotidů (C-A-G) v genu pro bílkovinu zvanou huntingtin (4). Podobně jako delece („vynechávky“) se mohou i inzerce (vsuvky) týkat pouze jednoho písmene nebo mnoha. Někdy dojde k inzerci proto, že molekulární aparát kopírující DNA se „zakoktá“, pokyny se nahromadí a aparát znovu zkopíruje oblast, kterou právě kopíroval, takže je kus DNA zkopírován dvakrát. Jindy se dlouhý kus DNA (v délce tisíců nukleotidů) z aktivního prvku z jedné oblasti DNA vkopíruje do genomu, kde dříve nebyl.
TABULKA 4.1: Typy genových mutací
Typ mutace:………………………… Popis:…………………………………
Substituce: …………………………..přepnutí jednoho druhu nukleotidu za jiný
Delece: ……………………………….vypuštění jednoho či více nukleotidů
Inzerce: ………………………………přidání jednoho či více nukleotidů
Inverze: ……………………………..„převrácení“ určitého segmentu dvojšroubovice DNA
Duplikace genu: …………………….zdvojení oblasti DNA obsahující gen
Duplikace genomu: …………………zdvojení veškeré DNA organizmu
Ke zvláštnímu druhu inzerce dojde tehdy, když dodatečná DNA pochází z jiného organizmu. Viry jsou kousíčky genetického materiálu, buď DNA či RNA, které napadají buňky a využívají buněčné zdroje k tomu, aby se rozmnožily. Někdy vkládají vlastní DNA do genomu hostitele, kde může zůstat po neomezeně dlouhou dobu. Jindy, zatímco virus replikuje vlastní genom, je částečka buněčného genetického materiálu náhodně přibrána a přidána do genomu viru. Přináší-li tento materiál navíc viru více dobra než škody, může se stát stálou součástí virového genomu.
Další druh mutace nazýváme inverzí. Když se něco v normálním chodu buňky trochu zvrtne, může být kousek dvojšroubovice DNA vystřižen, převrácen, a pak přišit zpět na místo. O tomto druhu mutace se předpokládá, že pomáhal rozdělit jeden druh ve druhy dva. Organizmy s převrácenými kousky DNA se mohou spolu pářit, ale často se tak úspěšně nepáří se svými „nepřevrácenými“ bratranci. Zdá se, že jeden druh komára, který přenáší malárii v západní Africe, se dělí do několika zvláštních druhů v důsledku rozsáhlých genomických inverzí (5).
Dalším typem mutace považovaným darwinisty za zvláště závažný je genová duplikace. Občas je celý gen či sada genů zkopírována na chromozomu dvakrát, takže zmutovaný organizmus má teď dvě či více kopií genu tam, kde ostatní zástupci druhu mají jen gen jediný. Například laboratorní odolnost vůči chlorochinu byla pozorována u některých malarických buněk, které mutací získaly další kopie segmentů parazitova chromozomu 3 (6).
Když se geny náhodně zdvojí, je to výborná příležitost pro evoluci. Jedna kopie genu se pak totiž může věnovat svému původnímu úkolu, zatímco druhá, přebytečná kopie genu je volná pro užití k odlišnému úkolu. Budeme se tím zabývat později a uvidíme, že ačkoli může genová duplikace za omezených okolností pomoci, při objasňování darwinovských procesů obecně nám to mnoho nepomůže.
Jak často se mutace vyskytují? Kterýkoli konkrétní nukleotid (jako řekněme ten, který umožní srpkovitou mutaci) je nově nahrazován asi jednou na sto milionů narozených (7). Malé vkladové a vypouštěcí mutace se objevují zhruba s touž četností. Zdá se, že také genové zdvojení se vyskytuje zhruba s touž frekvencí. Takže čítá-li populace určitého druhu sto milionů jedinců, pak průměrně jeden každý nukleotid je nahrazen u nějakého mláděte v každé generaci, a každý gen je také zdvojen u někoho, někde. A tak dále. Na druhé straně, čítá-li populace pouze sto tisíc jedinců, trvalo by tisíc generací, než by se vynořil určitý zdvojený gen nebo nahradil určitý nukleotid (průměrně) – protože tak dlouho by trvalo, než by se reprodukovalo sto milionů organizmů.
Abychom si dobře rozuměli. Ačkoli k substitucím, inzercím, delecím i duplikacím dochází vcelku zhruba se stejnou četností, je podstatný rozdíl mezi zbouráním něčeho starého a postavením něčeho nového. Je vždy snadnější a rychlejší vyhodit do povětří most než postavit nový. Například v historii lidstva se nová srpkovitá mutace (nikoli taková, kterou jedinec prostě zdědil od rodiče, který ji měl) objevila maximálně jen párkrát, snad dokonce jen jednou. Avšak talasémie se vynořila několik set krát. Důvod pro tenhle rozdíl v počtech je nasnadě. Aby člověk získal srpkovitý gen, musí být nahrazen jeden konkrétní nukleotid. Na druhé straně, aby člověk dostal talasémii (která narušuje gen pro hemoglobin), může být nahrazen či vynechán kterýkoli ze stovek nukleotidů a gen už nebude produkovat fungující bílkovinu. Kterákoli z velkého množství substitucí či delecí postačí. Obecně tedy platí, že mutace, které pomáhají v zákopové válce něco rozbít, se objeví s rychlostí několiksetkrát větší než mutace, které pomáhají vybudovat něco nového.
MŮŽETE SI VYBÍRAT PŘÁTELE, ALE…
Vědci pracující v minulých staletích si poprvé všimli, že existují pozoruhodné anatomické podobnosti mezi lidmi a dalšími druhy primátů. S příchodem moderní biologie mohly být též porovnány sekvence jejich bílkovin i DNA.
Jedním z vedlejších přínosů našeho nového pochopení DNA je to, že vědci ho mohou často využívat ke zjišťování, kdo je s kým příbuzný. Testy DNA mohou například ve sporných případech stanovit otcovství nebo určit, z které rodinné větve vzešla geneticky podmíněná nemoc. Můžeme tak dedukovat vztahy nejen mezi moderními lidmi, ale i s našimi dávnými předky. Porovnáváním sekvencí bílkovin a DNA můžeme zjistit s dostatečnou přesností původ Evy se srpky. V 80. letech 20. století porovnávali vědci data od moderních lidí a navrhli hypotézu „mitochondriální Evy“ – totiž že všichni moderní lidé jsou potomky jediné ženy, která žila před zhruba sto tisíci lety.
Ačkoli je to složitější a závisí to na více předpokladech, tytéž obecné metody a způsob uvažování, které stanoví vztahy mezi moderními lidmi i mezi moderními a dřívějšími lidmi, jsou též užívány ke zjišťování toho, jak jsou mezi sebou příbuzné různé druhy. Pokud dva druhy organizmů sdílejí to, co se jeví jako společná mutace či sada mutací ve své DNA, pak můžeme předpokládat, že společný předek oněch dvou druhů původně trpěl touto mutací a jeho potomci ji prostě zdědili. Připouštíme, že je nutno sáhnout k dohadům, ale ty se jeví mnoha lidem jako přijatelné.
Počátkem 60. let 20. století se začínaly objevovat první sekvence proteinů. Vědci byli šokováni. Mnozí z nich předpokládali, že biologické molekuly různých organizmů budou zcela odlišné. Ale ukázalo se, že molekuly jsou často podobné velmi pozoruhodně. Například jedním z prvních proteinů sekvenovaných ze široké škály organizmů byl hemoglobin. Sekvence hemoglobinu u různých druhů zrcadlila biologický klasifikační systém, který byl ustaven před staletími. Sekvence aminokyselin řetězce beta lidského hemoglobinu se velmi lišila od sekvence ryb, poněkud lišila od sekvence klokana (vačnatec), byla dost podobná sekvenci psa (placentální savec) a stejná jako sekvence šimpanze (9). Vzorec proteinu báječně zapadal do Darwinovy představy větvícího se stromu života. Nejen hemoglobin, ale mnoho dalších molekulárních podobností bylo objeveno mezi lidmi a dalšími primáty a v širším slova smyslu v základech veškerého života.
Mohla by existovat jedna zásadní námitka. Snad mají různá zvířata všechna podobný hemoglobin proto, že to je jediný protein, který může skutečně fungovat a účinně přenášet kyslík. Právě tak, jako všechny organizmy musí být založeny na uhlíku, protože uhlík je jediným prvkem, který je dost všestranný pro život, snad všechna zvířata prostě musí mít určité podobnosti ve svém molekulárním aparátu. Takže kterékoli velké zvíře by nutně muselo mít protein podobný hemoglobinu, i pokud vzniklo nezávisle na zvířatech jiných.
Tato námitka však neobstojí pro případ znaku sdíleného dvěma organizmy, který nemá žádnou funkční úlohu. Když dva rody sdílejí to, co se jeví jako libovolná genetická náhoda, pak je jisté, že jde o původ ze společného předka, tak jako je jisté, že jde o plagiát, když jeden spisovatel dělá tytéž neobvyklé chyby v pravopisu jako jiný, v týchž slovech. Tento druh důkazů vidíme v genomech lidí a šimpanzů. Například jak lidé tak šimpanzi mají narušený gen, který u jiných zvířat pomáhá tvořit vitamin C. Výsledkem je, že ani lidé ani šimpanzi si neumějí vytvářet vlastní vitamin C. Prošel-li předek obou druhů původně takovou mutací a pak ji předal oběma druhům, které se z něj vyvinuly, vysvětlovalo by to logicky takovou situaci.
Přesvědčivější důkaz toho, že lidé a další primáti měli společného předka, vychází ze studia jejich hemoglobinu – nikoli pouze jejich funkčního hemoglobinu, nýbrž i narušeného genu pro hemoglobin (10). V jedné oblasti svých genomů mají lidé pět genů pro proteiny, které hrají roli v různých stadiích vývoje (od embrya po dospělého) jako druhý řetězec hemoglobinu (podobný řetězci beta). Zahrnuje to gen pro samotný řetězec beta, dvě téměř identické kopie řetězce gama (který se vyskytuje ve fetálním hemoglobinu) a několik dalších. Šimpanzi mají úplně stejné geny v úplně stejném pořadí. V oblasti mezi dvěma geny gama a genem, který funguje po narození, obsahuje lidská DNA porušený gen (zvaný „pseudogen“), který úzce připomíná funkční gen pro řetězec beta, má však znaky ve své sekvenci, které mu znemožňují zakódovat úspěšně bílkovinu.
Šimpanzí DNA má na stejném místě velmi podobný pseudogen. Počátek lidského pseudogenu vykazuje dvě konkrétní změny dvou nukleotidových písmen, která jak se zdá znemožňují genu správně fungovat. Šimpanzí pseudogen má přesně stejné změny. O kousek níže v lidském pseudogenu je deleční mutace, kde chybí jedno konkrétní písmeno. Z technických důvodů tato delece nezvratně narušuje kódovací schopnost genu. Přesně totéž písmeno chybí v genu šimpanze. Před koncem lidského pseudogenu chybí další písmeno. V šimpanzím pseudogenu chybí také.
Tytéž chyby v tomtéž genu v týchž pozicích jak lidské tak šimpanzí DNA. Pokud u společného předka poprvé došlo k těmto mutačním chybám a následně z tohoto předka vznikly ony dva moderní druhy, pak by tento proces velmi případně vysvětloval fakt, proč mají nyní chyby oba druhy. Je těžké si představit, jak by mohl existovat pádnější důkaz pro fakt, že šimpanzi i člověk pocházejí ze společného předka.
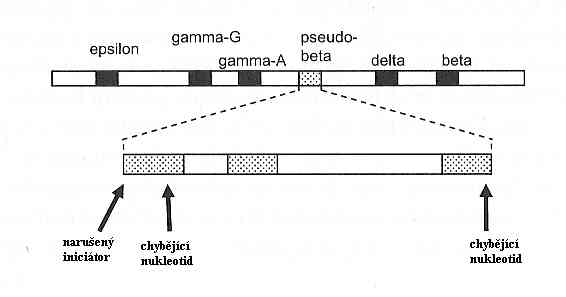
OBRÁZEK 4.1
Geny pro hemoglobin u člověka a šimpanze jsou si velmi podobné. Horní pruh je schematickou ilustrací oné oblasti genomů primátů, které obsahují geny pro řetězce hemoglobinu podobné řetězci beta včetně genu pseudo-beta (šedě), který nemůže produkovat funkční protein. Uspořádání je identické jak pro šimpanze tak pro lidi. Spodní pruh je podrobným pohledem na gen pseudo-beta. Šedé oblasti jsou oblastmi funkčních genů, které kódují část proteinu. Jak lidské tak šimpanzí geny pseudo-beta obsahují tytéž chyby, které jim znemožňují vyrobit fungující protein.
Onen jasný důkaz vyplývající z pseudogenu přesahuje svým významem předky člověka. Přes přetrvávající otázky (11) není důvod pochybovat o tom, že Darwin měl v tomto bodě pravdu a že všichni tvorové na zemi jsou biologičtí příbuzní.
Problém v podtextu je tento. Původ ze společného předka je pravdivý; ale jeho vysvětlení – i pokud se jedná pouze o lidi a šimpanze – , ačkoli je fascinující, je v hlubším smyslu triviální. Říká pouze to, že společné znaky zde existovaly od počátku, přítomné ve společném předku. Nepokouší se vysvětlit ani to, odkud se ony společné znaky vzaly nebo jak lidé následně získali pozoruhodné zvláštnosti. Cosi, co není náhodné, musí vysvětlit společný základ života.
JE DVAKRÁT TAK VELKOU HOUBOU NEŽ BYL JEHO TÁTA
Práce na hemoglobinových genech lidí a šimpanzů byla vykonána před několika desetiletími. Novější práce na celých genomech některých druhů kvasinek dále potvrzuje platnost myšlenky společného původu. Navíc tato linie analýz přinesla vědcům některé z oněch okamžiků výkřiku „heuréka“, které činí vědu tak napínavou – okamžiků, kdy nově získaná data náhle ozáří fádní krajinu jako záblesk v noci. Také tyto analýzy poukazují na meze náhodných mutací.
Ačkoli většina lidí má za to, že droždí je aktivní látkou, která způsobuje kynutí chleba nebo dává chuť pivu, biologové řadí kvasnice k houbám – vzdáleným příbuzným zvířat a rostlin. Vědci zabývající se kvasinkami měli dlouho podezření, že DNA pekařského droždí (jehož vědecké jméno je Saccharomyces cerevisiae – kvasinka pivní) má některé zvláštní rysy (12). Obsahuje totiž množství genů, které kódují velmi podobné proteiny, jež jak se zdá jsou v buňce téměř přebytečné. Zvláštní uspořádání genů vedlo dvě skupiny vědců k předpokladu, že někdy v dávné minulosti stálo snad pekařské droždí u původu všech genových duplikací. Místo pouhého jednoho genu nebo trsu genomu byla zdvojena veškerá DNA kvasinky! Místo zhruba 12 milionů nukleotidů, které měli jeho bratři a sestry, zázračné dítě jich mělo 24 milionů. Potomek byl rázem doslova dvakrát tak velkou houbou než byl jeho táta. Časem byla však většina ze zdvojené DNA ztracena delečními mutacemi.
Taková byla hypotéza – ale jak ji ověřit? Práce s pouhou sekvencí DNA pekařského droždí (S. cerevisiae) nemohla podezření potvrdit. Takže jedna skupina francouzských vědců nasekvenovala kompletní genomy – desítky milionů nukleotidů – čtyř dalších odlišných druhů kvasinek. Badatelé viděli, že zdvojené geny v pekařském droždí mohou být ztotožněny se svými protějšky v ostatních zkoumaných kvasinkách. Když byly srovnávány, jeden exemplář zdvojeného genu droždí býval někdy vedle levé poloviny některých genů, které tvořily jednu skupinu v jiném druhu kvasinek, zatímco druhý exemplář genu droždí býval vedle pravé poloviny skupiny v samostatné oblasti genomu droždí. Uvedené uspořádání odpovídá hypotéze – učiněné mnoho let předtím, než byly genomy sekvenovány – , že se veškerý genom droždí zdvojil a pak bylo časem mnoho zdvojených genů vypuštěno (13).
Tohle je další důkaz pro společný původ všeho živého. Na druhé straně se zdá, že zdvojení genomu neposkytlo svým organizmům veškeré výhody, které mohlo. Všech pět kvasinek má podobné tvary buněk i způsoby života (14). Zdvojené droždí má schopnost vyrábět alkohol, ale jedna nezdvojená kvasinka umí jíst ropu, prokazatelně složitější činnost. Jiný druh kvasinek obsahující více zdvojené DNA než droždí se vyhnul zdvojení celého genomu; zřejmě zdvojoval své geny staromódním způsobem – jeden po druhém (nebo v blocích).
Darwinisté s oblibou tvrdí, že zdvojení genomu je jednou ze zázračných tref náhodné mutace – poskytlo náhle genomu rozsáhlé nové možnosti. Zdá se však, že ani duplikace genomu – přebytečná kopie jednoho každého genu, s níž může evoluce pracovat – ani sto milionů let času nedaly droždí žádnou výhodu, kterou by již beztak nemělo (15). Tohle nás vede k velmi důležitému závěru. Náhodné zdvojení jednoho genu nebo dokonce veškerého genomu neposkytne organizmu nový komplexní aparát; poskytne pouze kopii toho, co již bylo přítomno. Ačkoli zdvojené geny můžeme použít k vystopování společného původu, ani zdvojení jednotlivých genů ani celého genomu samo o sobě nevysvětluje nové, komplexní formy života.
KROK ZA KROKEM
Jestliže genetika podpořila původ ze společného předka, jak je to s užitečností náhodné mutace? Tam to dopadá rozhodně méně dobře, ale i zde jsou vítězství, kterými se může evoluce pyšnit. Darwin tvrdil, že evoluce musí pracovat s nepatrnými, náhodnými, přínosnými změnami, které zvyšují pravděpodobnost, že zmutovaný organizmus přežije a bude prosperovat. Takže kdekoli vidíme takové malé přínosné změny nebo řadu takových změn, měli bychom uvěřit mudrlantovi z Downu. Takovým příkladem byla Eva se srpky i mutace, které vytvoří rezistenci malárie na chlorochin. Abych dokončil odpověď na otázku, zda darwinovská náhodná mutace může vysvětlit některé jednoduché znaky života, proberu ve zbytku kapitoly některé další případy, a začnu pár příklady vztahujícími se k malárii.
Když malárie vyvinula rezistenci vůči zázračnému léku chlorochinu, vědci rychle vyvíjeli nové léčebné postupy. Jeden z nových léků je pyrimethamin. Je zajímavé, že malárie mu umí čelit výměnou jediné aminokyseliny. Ona jediná změna aminokyseliny činí malárii stokrát odolnější na tento lék. Malarická DNA má pouze asi 23 milionů nukleotidů. V nemocné osobě může být až bilion parazitických buněk. Propočítáme-li to, pak by se rezistenční mutace měla objevit náhodně alespoň v jedné parazitické buňce u téměř každého nemocného. Jinými slovy, rezistence by se měla vyvinout nezávisle mnohokrát ve velké skupině pacientů léčených tímto lékem. Ale nedávná zpráva vědců z Národního ústavu zdraví poukázala na záhadu.
Protože rezistence vůči pyrimethaminu může být způsobena mutací jediného genu, předpokládalo se, že by k této odolnosti mohlo docházet často. Avšak nedávný průzkum mezi obyvatelstvem prokázal jen jediný zdroj rezistentních genů v pěti zemích: Thajsku, Barmě, Laosu, Kambodži a Vietnamu (16).
Jinými slovy, ačkoli odolnost v zárodku vzniká rychle a snadno, a proto bychom očekávali, že v zemi budou přítomny zmutované geny z mnoha různých malarických buněk, pouze jediný gen z jedné původní buňky dominuje oblasti široké skoro tisíc mil. Jak by k tomu mohlo dojít?
I když první mutace (na pozici 108 proteinu, jak to bývá) poskytuje určitou odolnost vůči léku, je malárie stále citlivá na větší dávky. Přidání dalších mutací (na pozicích 51, 59 a několika dalších) může zvýšit hladinu odolnosti. Avšak jako obvykle je tu háček. Některé z těchto dalších mutací (ne však ta první) zdá se omezují normální funkci proteinu. Snad ale pokud by jiné mutace v jiných genech mohly vyvážit tyhle škodlivé účinky, mohlo by být dosaženo větší odolnosti, aniž by v procesu docházelo ke škodám. Jinými slovy, zdá se, že aby se dosáhlo další hladiny odolnosti po první mutaci, jsou třeba dvě další, současně proběhlé mutace. Jak vědci zdůrazňují, „Protože k souběžným mutacím ve dvou různých genech nedochází tak často, pomohlo by to vysvětlit vzácnost, s níž se vyvíjela odolnost.“ (17). Nicméně, protože populace prvoka způsobujícího malárii bývá obrovská – nesrovnatelně větší než populace savců i jiných obratlovců – , může tato skutečnost překonat špatné pravděpodobnostní vyhlídky. Zřejmě (jako v případě odolnosti vůči chlorochinu) zde velmi šťastná malarická buňka v jedné nakažené osobě získala oněch několik změn, které jí daly větší odolnost vůči pyrimethaminu a zároveň přitom kompenzovaly nežádoucí vedlejší účinky. A onen vzácný mutant se pak rychle rozšířil v populaci. Zdá se, že onen dvojitý mutant je přibližně stejně vzácný jako CCC.
Druhý příklad toho, co přírodní výběr zvládne, pochází z ubohého, pronásledovaného komára, který bezděčně přenáší malárii z člověka na člověka. Roku 1946 byl poprvé užit insekticid DDT proti komárům v boji proti malárii. Analogicky k příběhu Evy se srpky se zmutovaní komáři odolní vůči DDT poprvé objevili hned roku 1947. Komáři mohou vzdorovat DDT tehdy, mají-li mutace ve svých genech pro enzymy, jejichž běžným úkolem je zbavovat chemikálie jedovatosti.
Takže hned po selhání DDT omezujícího populaci moskytů byly vyvíjeny další insekticidy. Jeden z nich je zaměřen na enzym, který je nezbytný pro fungování hmyzí nervové soustavy. Ačkoli tato chemikálie byla dříve užita na mouchách, které nakonec vyvinuly rezistenci, nebyla ve větším měřítku užita na komárech a ještě nebyli objeveni žádní komáři odolní vůči tomuto přípravku. Aby zjistili, zda by se komáři mohli stát odolnými, provedli někteří badatelé úmyslně v laboratoři u komářího genu tytéž mutace, které působily odolnost much. Změněný komáří gen se pak stal samozřejmě odolným také. A navíc, pracovníci prokázali, že byla třeba změna pouze jediné aminokyseliny, aby se dosáhlo odolnosti, a že přidání dalších mutací na správných místech mohlo onu odolnost ještě zvýšit (18).
Ačkoli se to ještě nevyskytlo v přírodě, neměli bychom být vůbec překvapeni, kdybychom se setkali s odolností komárů vůči novým insekticidům, která by vznikla a rozšířila se darwinovskými procesy. Nezbytné počáteční podmínky jsou všechny k dispozici: nepatrné, přínosné kroky – aminokyselina za aminokyselinou – , vedoucí od jedné biologické úrovně k další.
Existuje ještě jedno velmi důležité poučení, které lze vyvodit z reakce much/komárů na insekticidy, poučení jasně ukazující na omezení, jimž podléhá darwinovská evoluce. Mutace musí pracovat s daným buněčným aparátem, takže existuje velmi omezený počet věcí, které může dělat (19). Ačkoli ve hmyzím genomu existují nesčetné biliony eventuálních jednoduchých mutací, všechny kromě několika málo jsou irelevantní. V organizmech tak různorodých jako je komár a moucha se vynořuje pár stále stejných mutací, protože jiné prostě nefungují.
Zmíněné omezení jen potvrzuje naši dřívější teorii omezení v darwinovské evoluci, totiž fakt, že většina mutací narušuje celkové fungování organizmu – jsou destruktivní, nikoli konstruktivní, včetně toho malého zlomku mutací, které „fungují“. Vezměme si příklad jedu na krysy známého jako warfarin. Byl vyvinut v 50. letech 20. století. Warfarin snižuje srážlivost krve savců, takže krysa, která ho pozře, vykrvácí. Brzy poté, co byl warfarin zaveden, ztratil účinnost. Ukazuje se, že změna kterékoli z několika aminokyselin v jisté krysí bílkovině stačí na to, aby vznikla odolnost (20).
Pravděpodobnost, že zmutuje jedna z těchto konkrétních aminokyselin, je v řádu ubohé jedné ku sto milionům. Avšak protože na světě existuje patrně alespoň desetkrát tolik krys (tedy miliarda), je šance, že u některé krysy někde ve světě zmíněná změna proběhne, vlastně velmi dobrá. A opravdu, k mutaci s odolností vůči warfarinu došlo nezávisle asi sedmkrát na světě ve stejném krysím proteinu (21).
Jinak řečeno, odolnost vůči warfarinu nepoukazuje na silnou stránku náhodných mutací, nýbrž na jejich meze. Jelikož byla mnohokrát vybrána tatáž mutace, i když světová krysí populace obsahuje celou řadu odchylek ve všech krysích bílkovinách, svědčí tento fakt jasně o tom, že jediné účinné mutace jsou ty, které proběhly na oné jediné bílkovině. A navíc, ačkoli tyto mutace umožňují odolnost vůči warfarinu, snižují též účinnost enzymu, takže funguje pouze z poloviny tak dobře jako bílkovina normální. Jinými slovy, stejně jako u mnoha jiných mutací, které jsme studovali, i zde je změna čistým přínosem pouze v době zoufalé nouze.
ZMRZLÉ RYBY
Dosud probírané příklady darwinovského přírodního výběru byly všechny z relativně nedávné doby. Odolnost vůči moderním pesticidům jako třeba jedu na krysy nebo chlorochinu se vyvinula teprve v uplynulých několika desetiletích. Dokonce ani mutace, které prvně vedly k Evě se srpky a talasemii, se neobjevily dříve než před pouhými deseti tisíci lety. Existují dva důvody pro to, abychom se soustředili na příklady z relativně nedávné doby: Za prvé, naše informace o nich jsou dosti solidní a mnohem méně zamořené spekulacemi, které postihují většinu darwinovských pohádek; a za druhé, příklady z nedávné doby jsou fanoušky Darwina široce propagovány coby naše nejlepší příklady přírodního výběru v akci. Můj poslední příklad toho, co darwinizmus zvládne, je však mnohem starší a tedy i mnohem mlhavější. Nemůžeme tak snadno vymezit kroky, jakými se tento starší příklad ubíral, či změřit výhody každého z nich v laboratoři. I tak se však jeví jako celkem přesvědčivý.
Před více než deseti miliony let začaly vodní proudy kolem Antarktidy vytvářet uzavřenou smyčku, obíhajíce stále dokola nejjižnější kontinent. Jelikož už nepřijímal teplejší vodu z jiných částí zeměkoule, klesala pomalu teplota Antarktického oceánu, až se vytvořil led. Protože oceán obsahuje sůl, která snižuje bod tuhnutí vody, klesla teplota volného moře pod bod tuhnutí vody sladké a pak také pod bod tuhnutí tělesných tekutin. Vzhledem k tomu, že ryby jsou studenokrevní živočichové, jejichž tělesná teplota je táž jako teplota vody, v níž plavou, bylo zde nebezpečí, že zmrznou, když se jejich životní prostředí změnilo.
Rychle zpět o deset milionů let kupředu. Jedné skupině ryb, zvané ledovkovití, se daří v Antarktickém oceánu, i když je teplota oceánu pod bodem tuhnutí jejich krve. Jak mohou očividně popírat fyzikální zákony? Proč dnes nejsou přirozeně zmrzlé jako filé?
Ledovkovité ryby se mohou vysmívat ledu, protože vytvářejí některé úžasné proteiny, které doslova brání vodě ve zmrznutí. Ochladíme-li čistou vodu pod bod tuhnutí, neztuhne hned. Důvodem je to, že velké množství molekul vody se nejprve musí shluknout a vytvořit zárodečné krystalky. Jakmile krystalky vzniknou, rychle narůstají, až všechna voda ztuhne. Nevytvoří-li se však žádné zárodečné krystalky, může voda zůstávat tekutá nekonečně dlouho, i pod bodem tuhnutí. Abychom výklad zkrátili, mrazuvzdorné proteiny ulpí na zárodečných ledových krystalcích a zastaví jejich růst. Žádné zárodky, žádná tvorba ledu.
Roku 1997 nasekvenovala skupina vědců na univerzitě státu Illinois gen pro mrazuvzdorný protein z antarktické ryby. Byli šokováni, když objevili takzvané kontrolní oblasti vlevo i vpravo od části genu, který kódoval mrazuvzdorný protein. Tyto oblasti byly velmi podobné kontrolním oblastem pro jiný protein, trávicí enzym (22). Obě části měly jistou devítipísmennou sekvenci, avšak v mrazuvzdorném genu byla oblast devíti nukleotidů mnohokrát opakována. To dalo proteinu jednoduchou sekvenci, kterou tvořily tři aminokyseliny mnohokrát opakované (23).
OBRÁZEK 4.2
Schématické zobrazení možného vývoje jednoduchého mrazuvzdorného proteinu cestou malých náhodných mutací. A) Druhá kopie genu trávicího proteinu je vytvořena duplikací tohoto genu. B) Náhodně je zdvojena devítinukleotidová oblast genu (malý hrbolek na čáře), což přináší jednoduchou repetitivní sekvenci tří aminokyselin v proteinu, která má některé mrazuvzdorné vlastnosti. C) „Zakoktání se“ během replikace DNA vytváří mnoho dalších kopií jednoduché devítinukleotidové sekvence (zvětšený hrbolek), což zlepšuje mrazuvzdorné vlastnosti proteinu. D) Oblasti genu, které nepřispívají k mrazuvzdorné aktivitě, jsou náhodně vypuštěny.
Repetitivní sekvence = (mnohonásobně) opakovaná sekvence (např. nukleotidů v DNA); představují velkou část lidského genomu (pozn. překl.)
Vědci uvažovali o tom, že mrazuvzdorný protein se vyvinul darwinovským způsobem, náhodnými mutacemi a přírodním výběrem, a začalo to zdvojením genu pro trávicí enzym. Pravděpodobný scénář proběhl asi takhle: První kopie onoho genu prostě pokračovala v normální práci. Ale náhodou u jedné z ryb kdysi v antarktické oblasti se buněčný aparát zakoktal, když kopíroval druhý, zvláštní gen. Tohle škytnutí dalo zmutované rybě několik kopií devítinukleotidové oblasti. Změněný protein šťastnou náhodou trochu ochránil rybu od ledových krystalů, a tak se její potomstvo v ledovém oceánu více rozmnožilo.
Duplikace, zdvojení genu = přítomnost dvou kopií genu v genomu (ve vývoji umožnila získání nových vlastností jeho produktu mutací jednoho genu, zatímco druhý „zabezpečoval“ plnění dosavadních funkcí). (pozn. překl.)
U jednoho z rybích potomků původního šťastného mutanta patrně kopírovací aparát škytl opět a přidal ještě další devítinukleotidové repetitivní sekvence, čímž dále vylepšil mrazuvzdorný protein. (Tandemové repetitivní sekvence v DNA jsou obzvláště náchylné k opakovanému kopírování). Potomci tohoto druhého mutanta byli ještě zdatnější – byli s to přežívat ve vodě, která byla o poznání chladnější – , takže rychle ovládli celou populaci. Poté deleční mutace odstranila původní kódovací oblast, čímž snad přispěla k větší stabilitě mrazuvzdorného proteinu. Ještě jedna či dvě další mutace, opět blahodárné, a dosáhli jsme moderní verze proteinu.
Genové repetice = opakování genů ve více kopiích, 50 až 75% genů mnohobuněčných eukaryotických organismů existuje ve dvou nebo více kopiích (genové rodiny).
Tandemové genové repetice = bezprostředně za sebou se opakující geny, popř. skupiny genů. Existence vícečetných kopií daných genů je nutná pro zajištění dostatečného množství jejich produktů. (pozn. překl.)
Ačkoli jsme to přímo nepozorovali, jeví se tento scénář dosti přesvědčivý jako příklad darwinovské evoluce cestou přírodního výběru. Je přesvědčivý, protože každý z kroků je nepatrný – ne větší než krůček, který umožnil srpkovitou mutaci u lidí – a každý krůček znamená zlepšení. K původnímu zdvojení, které proces odstartovalo, dochází dosti často. Další mutace – zakoktání, které vedlo ke zmnožení devítinukleotidové sekvence – patří též k typu mutací, k nimž dochází relativně často (vzpomeňte si, zakoktání je druhem mutace, která vede k Huntingtonově chorobě u lidí). Další krok, vypuštění původní sekvence, také není neobvyklý.
Pravděpodobnost uvedeného scénáře podporují dva další objevy illinoiských vědců. Nepříbuzná skupina ryb z Arktického oceánu – přes celou polovinu světa – má gen, který kóduje velmi podobný mrazuvzdorný protein, s týmiž opakujícími se zbytky tří aminokyselin, ale s odlišnými kontrolními oblastmi vlevo a vpravo od genu (24). To naznačuje (ale samozřejmě nedokazuje), že mrazuvzdorné proteiny s touž jednoduchou repetitivní sekvencí nejsou nepravděpodobné. Ještě více zaráží, že pracovníci zjistili u ryb z Antarktidy hybridní gen, který obsahuje jak mrazuvzdornou sekvenci tak sekvenci trávicího enzymu, o níž se dříve domnívali, že byla vypuštěna v prvním genu, který zkoumali (25). V případě tohoto hybridního genu se skutečně zdá, že přistihli evoluci v akci. Přesně ten druh evoluce, který Darwin předpověděl.
POTUD, AVŠAK NE DÁLE
Jak uvidíme v příští kapitole, složitý interaktivní aparát – ať už v našem běžném světě či v buňce – nelze složit dohromady po částech. Některé jednoduché struktury však ano. Jedním příkladem z našeho rozlehlého světa je primitivní jez. Protože se nečistota hromadí, odtok v kuchyňské výlevce naší rodiny se velmi často zpomaluje a zastavuje. Nezáleží příliš na složení odpadků – kousky jídla, papír, velké i malé kousky. Okapové roury na našem domě se chovají také tak – kousky listů, větviček, semínek různé velikosti i další odpad je pravidelně ucpávají. I velké řeky se mohou ucpat postupným nahromaděním odpadu. V závislosti na konkrétních okolnostech může přitom jít o vývoj příznivý. Někdy může ucpaná řeka či potok náhodou některým zvířatům prospívat, pokud řekněme vytvoří jezírko. Zpomalení a eventuální přehrazení toku vody nevyžaduje sofistikované struktury – prostě jen spoustu odpadu. Genetický odpad se může také nahromadit v buňce. Je-li to náhodou k dobrému, pak toho může přírodní výběr využít. V jistém smyslu se právě tohle stalo v případě antarktických ryb.
Vzácné případy jako jsou antarktické ryby udržují darwinovskou myšlenku naživu. Ale pro skeptičtější pozorovatele zdůrazňují spíše meze náhodných mutací než jejich možnosti. Ukazuje se, že mrazuvzdorný protein u antarktických ryb není ve skutečnosti perfektně vymyšlená struktura srovnatelná řekněme s hemoglobinem. Hemoglobin a téměř všechny další proteiny jsou kódovány jednotlivými geny, které produkují proteiny o přesné délce. Připomínají přesně navržené a spočítané hráze. Avšak mrazuvzdorný protein kódují mnohočetné geny o různých délkách, přičemž všechny produkují řetězce aminokyselin, které jsou rozsekávány na menší kousky o různé délce – velmi podobné smetí v mém okapu. A opravdu, antarktický protein zřejmě nemá definitivní strukturu. Jeho aminokyselinový řetězec je měkký a rozprostřený, na rozdíl od velmi přesně složených tvarů většiny proteinů (jako třeba hemoglobinu). Mrazuvzdorný protein ani nevstupuje do interakcí s jinými proteiny jako proteiny zjištěné ve skutečných molekulárních aparátech, o nichž bude řeč v další kapitole.
Podobně jako u hráze přes vodní tok, kterou můžeme vylepšovat občasným přidáním větvičky nebo listu či kamene, je úloha mrazuvzdorného proteinu velmi jednoduchá a je relativně snadné zlepšovat tento protein přidáním nějaké složky. Nezáleží příliš na tom, zda větve v hrázi jsou větší nebo menší, mnoha různých typů či promíšené; pokud je jich dost, mohou řeku blokovat. A právě tak jako je mnoho způsobů, jak přehradit řeku, existuje mnoho způsobů, jak vytvořit mrazuvzdorné proteiny. Jak zdůrazňuje jedna skupina badatelů, „Mnoho různých proteinů se naučilo vázat led. Jde o atypický jev v evoluci proteinů [kurzíva od autora M. B.].“ (26).
Mrazuvzdorný protein objevený u antarktických ryb není ani tolik molekulárním aparátem jako příměsí do krve. Jinou analogií by mohlo být přirovnání ke stroji a mazivu, které mu umožňuje běžet. Mrazuvzdorný protein je podobný tomuto mazivu, které, ačkoli je třeba k tomu, aby buněčný aparát mohl pracovat, není ani zdaleka tak složité jako je stroj. A opravdu, za tím účelem, aby přežily v chladu, přidávají rostliny i zvířata často jednoduché chemikálie ke svým tělním tekutinám, podobně jako se přidávají nemrznoucí směsi do automobilů. (27). Ty také dělají svou práci.
Navzdory deseti milionům let evoluce s triliony ryb pod nemilosrdným selektivním tlakem v boji o přežití nemá antarktický mrazuvzdorný protein nic z promyšlenosti a složitosti byť jen tak jednoduchého proteinu jako je hemoglobin, neřkuli z úžasných, víceproteinových soustav, jimiž příroda oplývá. Místo aby směřoval k závažnějším jevům, jak doufali darwinisté, ukazuje mrazuvzdorný protein spíše na nejzazší hranici toho, co můžeme očekávat od náhodných mutací u obratlovců.
Abychom si uvědomili širší souvislosti, zamysleme se nad podobným problémem, který paralyzoval šíření malárie. Ačkoli je malárie dravým parazitem schopným pozřít prakticky vše, co mu přijde do cesty, potřebuje P. falciparum pro své rozmnožování teplé podnebí. Klesne-li teplota pod zhruba 18 °C, vývoj parazita se zpomalí. Při teplotě 16 °C se už rozmnožovat nemůže. Je to pro něj neřešitelný problém (28). Kdyby se objevil zmutovaný parazit, který by snášel trochu nižší teploty – ne snad přímo mráz, jen prostě chladné podnebí – , byl by s to napadnout oblasti, které jsou mu nyní uzavřeny. Navzdory obrovskému množství P. falciparum, které bylo k dispozici pro eventuální mutaci po tisíce let, se tak nestalo. Ne všechny zdánlivě prosté problémy lze zvládnout snadno či vůbec zvládnout.
POKLONA
Charlesi Darwinovi patří veškerá naše úcta. Ačkoli se o ní mluvilo již před ním, on proslavil myšlenku původu ze společného předka a shromáždil spoustu důkazů na její podporu. Navzdory některým záhadám ukazuje většina důkazů z projektů sekvenování genomu i z dalších prací velmi jasně na společný původ všeho živého. Darwin také navrhl koncepci náhodných variací/přírodního výběru. Výběr skutečně vysvětluje mnoho důležitých podrobností života – včetně vývoje srpkovitého hemoglobinu, odolnosti vůči lékům i insekticidům a tolerance vůči chladu u ryb -, kde pokrok může přicházet po malých krocích.
Avšak, ačkoli Darwin doufal v jiný výsledek, náhodné variace nevysvětlují nejzákladnější jevy v biologii. Nevysvětlují elegantní, sofistikovaný molekulární aparát, který je základem života. Abychom vysvětlili tyto jevy – a abychom vysvětlili kořeny a hlavní větve stromu života – , potřebujeme mnohočetné koherentní genetické mutace. Nyní, když víme, jaké mutace mohou postihnout DNA a co mohou vytvořit náhodné změny, můžeme začít s propočty k nalezení hranice evoluce s jistou přesností.
To, co nalézáme, je cosi zcela zásadního, ale odporuje to darwinismu: Většina mutací, které budují velké struktury života, musela proběhnout záměrně.
5. Kapitola: Co darwinizmus nezvládne
Smetí tarasící vodní tok má jen málo společného s Hooverovou přehradou. Obojí zpomaluje tok vody a vytváří velká jezera. Ale jen málo lidem by činilo potíže tyhle dva fenomény odlišit nebo poznat, že jenom jeden z nich je výsledkem náhodného nakupení větví a listů a bahna za určitý čas. V předešlé kapitole jsme zkoumali mutační větve, které se mohou nahromadit do ucpávky biologického smetí. V téhle kapitole se zamyslíme nad molekulárními Hooverovými přehradami.
Nejprve však malá poznámka k pojmu složitost. Ve své předešlé knize, Darwinova černá skříňka, jsem popisoval jisté složité biochemické struktury jako „nezjednodušitelně složité“ a tvrdil jsem, že darwinovské procesy postupující krok za krokem je nemohou vysvětlit, protože závisí na vzájemně propojených jevech. Kritici namítali, že se prostě jen pouštím do obtížného problému a že se vše nakonec vyřeší. Možná, že to o téhle kapitole řeknou zase. Ale objevy uplynulé dekády celý problém spíše zkomplikovaly, nikoli zjednodušily, jak na úrovni proteinového aparátu tak na úrovni instrukcí obsažených v DNA. Tahle kapitola ilustruje některé z těchto nových výzev a v kapitolách následujících objasním, jaké obecné závěry můžeme z nových faktů učinit.
VZHŮRU NOHAMA
Byl jsem na základní škole, když se stavěla observatoř Iacoccovy haly na univerzitě Lehigh. Zaměstnán studiem tří semestrů v asi sto mil vzdáleném Harrisburgu, neměl jsem nikdy příležitost vidět všechny ty jeřáby, míchačky, výklopné vozy a ocelové nosníky I, vidět všechny ty stroje i materiál přivážené na patřičná místa, aby tam byly smontovány správným způsobem s jinými příslušnými součástkami tak, aby vznikla budova, kde nyní pracuji. Avšak jako většina z nás jsem sledoval stavbu jiných budov, takže si mohu domyslet, jak se věž Iacoccovy haly budovala. Podobně jako všechny takové budovy byla stavěna způsobem, který bychom mohli nazvat „vzhůru nohama“. Obratem „dnem vzhůru“ chci říci, že samozřejmě musely být nejprve vybetonovány základy budovy, pak přízemí a tak dále až po zakončení v šestém patře. Vyšší patra se musí stavět na patrech předcházejících.
Iacocca [ajakoka] Lido Anthony „Lee“, americký průmyslník, nar. 15. 10. 1924 v Allentownu; platí za jednoho z nejúspěšnějších manažerů všech dob. (pozn. překl.)
Obratem „vrškem dolů“ mám na mysli to, že budova byla naplánována. Pracovalo se podle projektové dokumentace, objednal se materiál, byl zakoupen pozemek, přivezeny stavební stroje a tak dále – vše se záměrem vybudovat nakonec strukturu observatoře. Samozřejmě nemusely být promýšleny zanedbatelné podrobnosti budovy. Například nezáleželo úplně na přesné barvě betonu, pokud to stále byl nějaký ten osvěžující odstín šedi. Nebo nebylo důležité přesné umístění zábradlí podél vnitřního schodiště, pokud bylo v rozmezí určité vzdálenosti od podlahy. Nicméně hlavní strukturální aspekty budovy byly promyšleny před začátkem stavby a realizace projektu se dlouho připravovala. Nutnost stavět vzhůru nohama se zdaleka netýká jen budov v Bethlehemu, Pennsylvania. Všechny hlavní projekty konstrukcí takto postupují. Takže kdykoli vidíme dobře postavenou strukturu, můžeme si být jisti, že byla naplánována.
V právě uplynulém desetiletí či tak nějak objevila věda neočekávaně takovou konstrukci vzhůru nohama v místě, které ještě před několika málo lety nebylo viditelné. Nebylo vidět, protože nebylo k dispozici optické zařízení nutné k jejímu spatření. Byla zjištěna výkonným novým mikroskopem zkoumajícím podrobně zelenou řasu Chlamydomonas, oblíbený laboratorní organizmus důvěrně známý jako chlamy. Od té doby byl tentýž typ konstrukce zjištěn u velmi široké palety buněk.
V Darwinově černé skříňce jsem podrobně psal o velkých buněčných strukturách zvaných řasinky a bičíky, které obě pomáhají buňkám otáčet se v tekutině a fungují jako vrtulky. Neměl jsem tenkrát představu o tom, jak složité ve skutečnosti jsou. Jak řasinka tak bičík jsou rozměrné součásti buněčného aparátu – tedy rozměrné ve srovnání se samotnou buňkou. Ačkoli obě jsou poměrně tenké, jejich délka může být mnohonásobně větší než délka buněk, k nimž jsou přichyceny. Ukazuje se, že konstrukce rozměrných struktur v buňce vyžaduje týž stupeň plánovitosti – tutéž prozíravost, totéž hromadění zásob materiálu, tytéž složité nástroje – , jako tomu bylo při budování observatoře v Iacoccově hale. Vlastně vyžaduje mnohem větší promýšlení, protože celý proces uskutečňují nechápající molekulární roboti, nikoli myslící konstruktéři a dělníci, kteří staví budovy v našem běžném světě.
OBRÁZEK 5.1
Počítačově upravený obrázek části řasinky seříznuté tak, aby bylo vidět jednotlivé orgány. Každá kulička je protein přibližně tak složitý jako hemoglobin. Řasinka se skládá ze zhruba dvou set různých proteinů. (Přetištěno z článku H. C. Taylora a M. E. J. Holwilla, 1999, Axonemální dynein – přirozený motor molekuly. Nanotechnology 10:237-43. S laskavým svolením IOP Publishing).
HUSÍ KOLÉBÁNÍ
Roku 1993 zkoušel Keith Kozminski, tehdy čerstvý absolvent univerzity v Yale, zcela nový mikroskop (1). Přístroj měl všechny možné přednosti, včetně schopnosti nahrávat na video buňky v reálném čase. Kozminski ho zaměřil na řasinku jednobuněčné řasy Chlamydomonas a nafilmoval to, co nikdo v lidských dějinách nikdy předtím neviděl. Pohyb jedné části řasinky nahoru a druhé dolů byl sérií tupých nárazů – batolící se husy! Videonahrávku takového „intraflagelárního transportu“ (zkratkou IFT; omylem jsou řasinky také někdy nazývány „bičíky“, odtud „intraflagelární“) můžeme vidět na webu (2).
Kozminski a jeho spolupracovníci hned věděli, že musí existovat spousta složitého aparátu za oním prostě vypadajícím houpáním. Předpokládali, že vlnky se ve skutečnosti podobají jedoucím nákladním vagonům dopravujícím náklad po řasince nahoru a hnaným různými motorovými proteiny. Vlnky se pohybovaly nestejnou rychlostí; jely dvakrát tak rychle, když se vracely, než když vyjížděly z buňky směrem k vrcholu řasinky. Z toho badatelé vyvodili, že existují dva samostatné mechanizmy odpovědné za cestu nahoru a dolů. Přepnutím z videonahrávek na momentky pořízené mikroskopem s vysokou rozlišovací schopností mohli pracovníci zjistit některé podrobnosti vlnek. Viděli skupinky – později nazvané „vory“ – až čtyřiceti lízátkovitých částic umístěných mezi vnějším obvodem proteinové části řasinky a membránou, která ji obklopuje. Na rozdíl od některých dalších typů dopravního aparátu v buňce neměla lízátka tvar „váčků“. To znamená, že nešlo o uzavřené prostory obalené proteinem nebo blanou.
Kombinací šťastné náhody a obratnosti bylo otevřeno okno do elegantního a nečekaného buněčného aparátu. V desetiletí od okamžiku, kdy Keith Kozminski poprvé zahlédl IFT, bylo dosaženo úžasného pokroku při detailním zkoumání množství proteinových hráčů v celém mechanizmu jakož i oněch často strašlivých důsledků toho, kdy mutace naruší jeho práci. Na několika dalších stranách se podíváme na některé podrobnosti IFT.
STAVBA VĚŽE
IFT je proces, který staví a udržuje řasinku. Odřízneme-li řasinku od buňky chlamy, bude jiná vytvořena přibližně za hodinu. Během téhle hodiny můžeme pozorovat vory IFT, jak se pilně pohybují nahoru po jedné straně rostoucí struktury a dolů po straně druhé. Pokud je však šikovnými laboratorními manipulacemi jedna či více proteinových složek IFT úmyslně narušena, nebude už uříznutá řasinka nikdy znovu vytvořena.
Při stavbě vzhůru nohama jsou z praktických důvodů materiály často shromážděny předem a přivezeny na staveniště. To byl jistě případ věže Iacoccovy haly a je tomu tak i v případě řasinky. Než se začne stavět nová řasinka, jsou buněčné materiály přepraveny na shromaždiště u spodku toho, co bude novou strukturou. Samozřejmě v případě lidských konstrukcí vědí myslící dělníci, které materiály potřebují, poznají je a na staveniště přivezou pouze nutné materiály. V buňce však musí tohle vše vykonat vysoce sofistikované, automatické mechanizmy. Byla vyslovena domněnka, že v oblasti blízko základny nové řasinky fungují věci zvané „modulační tkaniva“ jako filtry zadržující nechtěné, potenciálně rušivé materiály. Douglas Cole z univerzity Idaho uvažoval, že pokud by tomu opravdu tak bylo – pokud by konstrukční materiály potřebovaly vstupenku, aby se dostaly do řasinky -, pak by žádné nové materiály nebyly vpuštěny přes modulační zónu do řasinky, pokud by byl IFT experimentálně zastaven. Přesně tohle bylo pozorováno u několika mutantů chlamy (3). Přesné podrobnosti filtrovacího mechanizmu ještě nejsou známy, ale můžete si být jisti, že nebudou jednoduché.
Jako všechny analogie i srovnání stavby řasinky s projektem stavby lidské selhává v řadě aspektů, přičemž všechny zdůrazňují mnohem větší sofistikovanost konstrukce buněčné. Zmíním se zde pouze o jednom takovém aspektu. Lidští konstruktéři opouštějí projekt budovy jakmile je dokončena, což není případ buňky. Pokud experimentálně přerušíme IFT v buňce, která má již plnohodnotnou, dokončenou řasinku, začne se řasinka okamžitě smršťovat, až zmizí úplně. IFT pokračuje po celou dobu života řasinky, přičemž nejenže stále přináší nové kopie řasinkových součástí, ale též odstraňuje materiál starý. Experimenty prokázaly, že ve zdánlivě stabilních řasinkách, jejichž délka zůstává konstantní, je během několika hodin vyměněno přes osmdesát různých druhů proteinů, což se rovná 20 procentům hmotnosti řasinky (4).
OBRÁZEK 5.2
Intraflagelární transport (IFT). Molekulární přepravky vyvážejí proteinový náklad z buňky ke špičce bičíku. Pak se vracejí prázdné. Vědci soudí, že pro udržení správné délky řasinky poté, co je vytvořena, se větší procento přepravek přepne ze stavu „schopna nákladu“ do stavu „neschopna nákladu“. (Přetištěno z Snell, W.J., Pan, J., a Wang, Q., 2004: Pravda o řasinkách a bičících. Od soustavy bičíků u Chlamydomonas k potížím s lidskou obezitou. Cell 117:693-97. S laskavým svolením Elsevier Publishing.)
Současný model IFT staví na tom, že přepravky (vagonky) jsou na počátku stavby většinou plné. (Obrázek 5.2). Když je stavba hotová, přijíždějí vláčky stále přibližně touž rychlostí, ale nyní jsou některé vagonky prázdné. Zřejmě si nějaký dosud neznámý přepínací mechanizmus uvědomuje, kolik materiálu řasinka v tom kterém okamžiku potřebuje, a mění kapacitu vagonků z polohy „nákladuschopný“ do polohy „nákladuneschopný“ podle okamžité potřeby. Na rozdíl od věže Iacoccovy haly je řasinka dynamickou strukturou, v níž jsou mnohé z jejích proteinových součástí aktivně měněny v závislosti na měnících se vnitřních i vnějších podmínkách.
PLNÝ MONTY
Psát o IFT jako o aparátu, který užívá „vagonky“ ve tvaru „lízátek“, které jezdí po molekulárních „kolejích“ je samozřejmě dětinské. Tohle žvatlání má seriózní účel – zdůraznit některé důležité, obecné body, aniž bychom momentálně zabředli do příliš mnoha podrobností. Ale přichází okamžik, kdy musíme předložit podrobnosti v plné šíři. Skutečný vlak, řekněme parní lokomotiva, obsahuje velmi mnoho součástí, které musí být všechny plně funkční, aby vlak mohl jezdit. Strojvůdce, který by lehkomyslně ignoroval podrobnosti těchto součástí, by brzy zjistil, že má na krku stotunové těžítko neschopné pohybu. Stejně tak obsahuje aparát IFT mnoho proteinových součástí. Bezprostředně obsahuje nejméně šestnáct druhů proteinů, každý z nich sám o sobě zhruba tak složitý jako hemoglobin. A právě tak, jako může mutace v jedné z více než sta aminokyselin ať už v řetězci alfa či beta hemoglobinu způsobit zhoršení jeho funkce, platí totéž pro onu spoustu proteinových součástí IFT. V příštích několika odstavcích nahlédneme přímo do jícnu biochemické složitosti IFT, načež se z něho vrátíme, abychom se nadechli. Nebojte se, nebudete si muset pamatovat názvy jednotlivých složek nebo jiné podrobnosti. Jde o to, abychom ozřejmili, jak elegantní a vzájemně provázaný celý souvislý systém je – abychom ozřejmili, jak je odlišný od zlomených genů a zoufalých kroků, které s sebou běžně přináší náhodná mutace. Čtenáři, kteří necítí potřebu nořit se do takových podrobností nechť tyto řádky přeskočí a věnují se další kapitole.
Biochemické studie ukazují, že IFT lze pojmově rozdělit na několik částí. První část tvoří motorické proteiny, které dopravují částice IFT uvnitř řasinky. Motorický protein, který dopravuje částici k vrcholu řasinky, se liší od proteinu, který ji dopravuje zpět. Dopravu vzhůru pohání kinesin-II, člen rodiny kinesinových motorických proteinů, které zastávají v buňce řadu úkolů. Kinesiny se vyskytují v řadě strukturálních variant. Kinesin-II nalézáme pouze v buňkách, které mají IFT, nikoli však v buňkách jako třeba buňky kvasinek a vyšších rostlin, které IFT nemají. (Kvasinky a vyšší rostliny nemají řasinky). Z jedné studie vyplynulo, že buňky, které obsahují zmutovaný, křehký kinesin-II, mohou tvořit řasinky za nižší teploty (asi 20 °C), kdy zmutovaný protein funguje. Avšak za vyšší teploty (32 °C), kdy je protein nestabilní, se IFT zastavil a řasinky začaly být opět vstřebávány. Pohon k cestě zpět obstarává motorický protein dynein. Když byl zmutovaný, oslabený dynein vpraven do buněk chlamy, které neměly řasinky, byly nově utvářené řasinky velmi krátké a napěchované částicemi IFT, které obsahovaly kinesin-II. Zřejmě tedy aparát pro vpravování částic dovnitř pracoval dobře, ale aparát pro odstraňování částic byl narušen, takže počínající řasinka byla příliš naplněná. Co přesně způsobuje, že se IFT přepne z dopravy poháněné kinesinem na dopravu dyneinem na špičce řasinky, zůstává záhadou.
Druhou podstatnou část IFT nazýváme částicí IFT. Jde o nádobku, která shromažďuje správné proteiny k dopravě na řasinku či z ní a uvolňuje je na patřičném místě. Částici IFT tvoří šestnáct zvláštních proteinů, které se váží do jednoho celku. Za jistých experimentálních podmínek můžeme tento komplex šestnácti proteinů rozdělit na celky dva – zvané A a B – , které obsahují šest respektive deset proteinů. Není to jisté, ale zdá se, že celky A a B mohou hrát v buňce různou úlohu (5). Proteiny komplexů A a B obsahují podstruktury, které jsou známé tím, že obzvláště dobře zvládají vázání různých proteinů – přesně to, co je třeba, aby se dopravily všechny druhy proteinového nákladu, které IFT dopravuje po řasince.
POROUCHANÝ VLAK
Chybějí-li části železničního dopravního systému či jsou-li porouchány – posune-li se pražec, chybí-li nýt či dva, zlomí-li se šroub držící kolo na lokomotivě – , není k neštěstí daleko. Stejně je tomu v případě IFT. Řasinky nejsou jen vesla mávající ve vodě – účastní se širokého spektra důležitých biologických funkcí. Nejsou-li přitom v dobrém stavu, mnoho věcí se může pokazit. V posledním desetiletí bylo prokázáno, že poruchy IFT negativně ovlivňují mnoho důležitých procesů.
První náznak toho, že řasinky plní mnoho skrytých, ale životně důležitých úkolů, přišel v polovině 70. let 20. století, když švédský vědec Björn Afzelius informoval o případech čtyř mužů, kteří trpěli neplodností a chronickou sinusitidou. Jelikož ocásek lidské spermie tvoří modifikovaná řasinka, která ji pohání při plavání, a jelikož řasinkové buňky vystýlají sinusové dutiny, zkoumal Afzelius dýchací tkáň pacientů a kontroloval jejich řasinky. Ačkoli byly řasinky přítomné, postrádaly dynein, svou běžnou součást, a tak nebyly schopny se pohybovat. Afzelius si také všiml u svých pacientů čehosi zvláštního – několik z nich mělo situs inversus, to znamená, že měli srdce na pravé straně těla a játra na levé, opačně, než je tomu normálně. Afzeliovo pozorování svědčilo o tom, že cosi, co narušuje řasinku, může způsobovat záměnu levé strany za pravou. Roku 1999 provedlo několik japonských badatelů genetickou manipulaci u myší v tom smyslu, že jim odebrali jeden z proteinů, které tvoří kinesinový motor IFT. Myši zemřely před narozením. Zkoumání embryí prokázalo, že mnoho z nich mělo situs inversus. Jedním ze závěrů tedy je, že řádně fungující IFT je nutné pro správný vývoj embrya (6).
Další oblastí ovlivňovanou IFT je zrak. Ve světločivných buňkách sítnice obratlovců – tyčinkách a čípcích – je velký vnitřní segment (IS) spojen krčkem s velkým segmentem vnějším (OS). IS obsahuje střeva buňky – jádro, ribozomy atd. – ,zatímco OS má specializovaný aparát zaměřený na vidění. Jelikož jsou všechny zásoby potřebné pro OS nejprve sestaveny v IS, musí být dopraveny z jedné části buňky do druhé. Spojovací krček je vlastně upravenou, nepohyblivou řasinkou, takže vědci mají podezření, že zásoby se dostávají k OS prostřednictvím IFT. Tuto hypotézu posílil nedávný výzkum, který prokázal, že mutace v pouhém jediném ze šestnácti proteinů IFT u myší způsobuje degeneraci sítnice těchto hlodavců (7). V jiné studii byl u laboratorních myší úmyslně poškozen kinesinový motor IFT; proteiny, které jsou normálně přepravovány ven k OS, se hromadily v IS. Nakonec, jak to činí mnoho špatně fungujících buněk, aktivovaly poškozené světločivné buňky svůj program sebezničení a spáchaly sebevraždu.
U lidí, kteří trpí polycystickou nemocí ledvin, se vyvíjejí velké cysty na ledvinách (a také na dalších orgánech) a dochází u nich k pozvolné ztrátě ledvinové tkáně, což vede k selhání ledvin. Jelikož jsou ledviny nutné k tomu, aby filtrovaly krev, mohou být důsledky smrtelné. Studie na lidech prokázaly, že s nemocí jsou spojeny mutace v genech pro některý ze dvou proteinů zvaných polycystin-1 a polycystin-2. Polycystin-2 nalézáme v jistých ledvinových řasinkách. V experimentech na myších vyřadilo úmyslné poškození jednoho z proteinů IFT stavbu těchto řasinek a vedlo u zvířete k polycystické nemoci ledvin (9). Závěr zní, že IFT je též nutné pro řádnou funkci ledvin.
Kromě své role při vývoji embrya a fungování oka a ledvin hraje zřejmě IFT v buňce mnoho dalších úloh. Experimenty ukazují na funkce při vnímání koncentrace chemikálií v roztoku (osmotické vnímání), přijímání chemických signálů, kopulačním chování červů a dalších jevech.
NEZJEDNODUŠITELNÁ SLOŽITOST JE ŘÍZENA
Když jsme dětmi, zdá se život jednoduchý. Nevíme, jak svět opravdu funguje ani nevíme dost na to, abychom se správně ptali. Naši rodiče nám všechno koupí; naše vlast je nám svatá; naše škola je ta nejlepší. S tím, jak vyrůstáme, objevuje většina z nás fakt, že věci nejsou tak jasné, jak se nám zprvu zdálo. Násilnický spolužák nám dá pěstí do nosu; slyšíme o tom, že některé z činů naší vlasti odsuzují lidé, jejichž mínění si vážíme; táta nám řekne, že si už musíme sami začít vydělávat – on už nám auto prostě nekoupí. Život se víc a víc zašmodrchává. Stejná je situace v biochemii. V Darwinově éře v devatenáctém století se buňka jevila nudně prostá. Význačný embryolog Ernst Haeckel ji nazval „obyčejnou hrudkou bílkovinné kombinace uhlíku“ (10) – jinými slovy, prostě jakousi jednotvárnou šmírou. S tím, jak léty vyzrávala, poznávala věda, že buňka je nesrovnatelně složitější, než se Haeckel domníval.
Nyní poznáváme, že i řasinka je strašně složitá. Víme teď, že řasinka je víc než pouhým veslem zabírajícím do vln, dobrým tak pro plavbu či prohánění tekutiny skrz tkáň. Je také složitým chemickým čidlem zapojeným do širokého spektra biologických procesů. Je dynamická ve spoustě nezávislých ohledů – ne pouze mechanicky dynamická, nýbrž i funkčně dynamická, jelikož je neustále dostavována, aby lépe reagovala na své okolí a spolupracovala s ním.
A teď problém její nezjednodušitelné složitosti nesmírně narostl. Podívejme se na pastičku na myši – příklad nezjednodušitelné složitosti, o němž jsem psal v Darwinově černé skříňce. Standardní mechanická pastička potřebuje ke svému fungování nespočet součástí. Odstraníme-li pérko či zlomí-li se kovová tyčka, do pastičky se žádné myši nechytí. Navzdory vynalézavému, ale spornému úsilí Darwinových fanoušků v posledním desetiletí (11) je nesmírně obtížné pochopit, jak se mohlo cosi jako pastička na myši vlastně vyvinout díky něčemu blízkému slepým darwinovským procesům hledání. Ale pojďme nahlédnout za strukturu pouhé samotné pastičky. Představte si automatizovanou továrnu na pastičky, která montuje součásti pastí, osazuje je a seřizuje past pokaždé, když opouští výrobní linku. Je zřejmé, že složitost takového systému je mnohem větší než složitost samotné pastičky. A tak jako naděje na výhru v loterii Powerball rapidně klesají s tím, čím více čísel musíte uhodnout, stoupá obtížnost snahy vysvětlit, jak by mohl systém vyrábějící pasti vzniknout „četnými, postupnými, malými modifikacemi“ (jak to požadoval Darwin ve své teorii) geometrickou řadou tím více, čím více jednotlivých druhů součástek systém obsahuje.
IFT pak zvyšuje geometrickou řadou obtížnost vysvětlit nezjednodušitelně složitou řasinku. Je jasné z pečlivé experimentální práce se všemi buňkami majícími řasinky, které byly zkoumány, od řasy po myši, že fungující řasinka vyžaduje spolehlivě pracující IFT (12). Problém původu řasinky je teď niterně propojen s problémem původu IFT. Před jeho objevením jsme si mohli odpustit přehlížení problému toho, jak je řasinka stavěna. Biologové mohli lehkovážně přehlížet tenhle problém vědouce, že se prostě nějaké proteiny tvoří samy a spojují se v buňce bez číkoli pomoci. Právě tak, jako si před stoletím Haeckel myslel, že život vzniká snadno, před několika desetiletími jsme mohli klidně mít za to, že je patrně snadné vytvořit řasinku; její části se patrně mohly slepit dohromady jen tak. Avšak teď, kdy byla odhalena elegantní složitost IFT, nemůžeme už tuhle otázku přehlížet.
Jak vysvětlují darwinisté řasinku/IFT? Roku 1996 v Darwinově černé skříňce jsem podal přehled názorů vědeckých časopisů a ukázal, že bylo podniknuto velmi málo pokusů za účelem vysvětlení, jak se mohla řasinka vyvinout způsobem popisovaným Darwinem – existovalo skutečně jen málo takových pokusů. Ačkoli biolog z Brownovy univerzity Kenneth Miller tvrdil v odpovědi na mou knihu, že řasinka s dvěma sty složkami není vlastně nezjednodušitelně složitá, nenabídl žádné darwinovské vysvětlení pro původ řasinky postupnými kroky. Millerovou hlavní profesí je však studium struktury a funkce biologických membrán a jeho replika se objevila v knize určené pro farmaceutický průmysl, nikoli ve vědecké literatuře. A ani aktualizované zkoumání vědeckých časopisů, v nichž experti na danou oblast zveřejňují své práce, nesvědčí o seriózním pokroku v otázce darwinovského vysvětlení pro krajně složitou řasinku (13). Navzdory úžasnému pokroku molekulární biologie jako celku, navzdory nasekvenování stovek kompletních genomů a dalším průlomům ve vědění, navzdory výzvě samotné Darwinovy černé skříňky zůstala situace ohledně chybějících darwinovských vysvětlení vývoje řasinky po více než deset let od chvíle, kdy jsem na ni poukázal, naprosto nezměněna (14).
O původu řasinky/IFT náhodnými mutacemi může darwinovská teorie říci jen málo zásadního. Je tedy logické konstatovat, že darwinovská teorie je mizernou základnou pro pochopení původu řasinky.
Řasinka nevznikla šťastnou náhodou. Tahle buňka je plná struktur, jejichž složitost je podstatně větší než jsme ještě před deseti lety věděli. (V Dodatku C probírám jemné podrobnosti bakteriálního bičíku a jeho stavby, pro čtenáře, které baví hodně detailů.) Hlavní otázkou samozřejmě je: „Mohou tohle vysvětlit mutace DNA?“ Nebo spíše, mohou to vysvětlit náhodné mutace? Život vznikl ze společného předka, takže DNA skutečně mutovala – probíhaly změny od druhu k druhu. Co však řídilo tyhle zásadní změny?
Opakujíce Darwinovy vlastní chyby, poukazují moderní darwinisté na důkazy o původu ze společného předka a mylně se domnívají, že tak dokazují i sílu náhodných mutací (15). Nemůže-li se však moderní malárie vyrovnat s jedinou změnou aminokyseliny v srpkovitém hemoglobinu, proč bychom si měli myslet, že soustavu IFT vytvořily náhodné mutace v jakési prastaré buňce? Je-li lidský genom podstatně poškozován zákopovou válkou s P. falciparum, proč si myslíme, že soutěžení by vytvořilo elegantní molekulární přívěsný motor? Kladení takových otázek implikuje již i příslušnou odpověď. Neexistují důkazy o tom, že darwinovské procesy mohou vytvořit něco tak elegantního a složitého jako jsou řasinky.
NAČASOVÁNÍ JE VŠÍM
Přirovnáme-li řasinku k věži Iacocca Hall, pak IFT můžeme přirovnat k buldozerům, jeřábům a jiným strojům nutným k tomu, aby byla postavena. To však není všechno, co je třeba ke stavbě vzhůru nohama. Abychom zhodnotili onu masivní výzvu, kterou buněčné systémy představují pro náhodné mutace, musíme vzít v úvahu více než pouhé fyzické znaky, více než jen samotné hotové struktury a stavební stroje nutné pro jejich výstavbu. Musíme se též zamyslet nad molekulárním plánováním, které má vliv na celý projekt. Genetická kontrola plánování je v jistých ohledech tím nejobtížnějším aspektem každého molekulárního konstrukčního procesu, který mají vědci zkoumat, je však neméně důležitá než jsou fyzické součásti tvořící konečnou strukturu.
Velký stavební projekt musí být řízen spořádaným způsobem. Správný stavební postup zde není nutný kvůli nějaké posedlosti krásou; je nutný proto, že je-li ve hře příliš mnoho strojů a dalších zařízení na staveništi, mohou si navzájem překážet. Kdyby byla všechna zařízení nutná pro kompletaci kancelářské budovy přítomna na místě od počátku, pletla by se jedno druhému do cesty; některá by se poškodila, stroje by si mohly překážet. Kdyby byl na počátku kancelářský nábytek rozházen po staveništi, v téže době, kdy se tam poprvé objevila parní lopatová rypadla, aby vyhloubila základy, pak by nábytek patrně nabrala na lopaty či rozdrtila pod koly tahačů. Vedlo by to jen ke zmatku.
Fyzická stavba buňky je téměř výhradně záležitostí proteinů. Proteiny představují molekulární buldozery, parní rypadla, lokomotivy, vagony, koleje i všechno ostatní vybavení, jak velké tak malé, nutné pro stavební projekty. Geny, které proteiny kódují, jsou samozřejmě složeny z DNA, takže vlastně veškeré informace nutné k tvorbě veškerého materiálu potřebného pro stavbu – jak stavebních strojů tak materiálů, z nichž je postavena samotná kancelářská věž – jsou obsaženy v DNA. Kromě těchto genů má však buněčná DNA též oblasti, které fungují jako kontrolní signály. Kontrolní signály DNA, ve spojení s kontrolními proteiny, instrumentují celý projekt, aby zajistily, že bude připraven správný aparát ve správnou dobu v náležitém množství.
Ukázat, jak buňka funguje, je velmi těžká práce, a mnoho zůstává neobjasněno. Ačkoli v posledním desetiletí byly odhaleny aspekty IFT, kontrolní program pro tvorbu řasinky je stále do značné míry záhadou. V téže době byl však učiněn pozoruhodný pokrok v poznání hlavních rysů kontrolního programu pro další velkou strukturu, bakteriální bičík (viz Dodatek C). V kostce, bakteriální bičík je přívěsným lodním motorem, který bakterie užívají k plavání. Abych ilustroval plánování, které musí předcházet molekulární stavbě bičíku, popíšu v několika dalších odstavcích to, co se vědci nedávno dověděli o kontrole stavby bičíku. (Někteří čtenáři možná tuhle pasáž přeskočí a začtou se až do další kapitoly).
Právě tak, jako přívěsný motor motorového člunu v našem běžném světě tvoří velké množství součástí (lodní šroub, zapalovací svíčky a tak dále), je tomu tak i v případě molekulárního přívěsného motoru. Bičík má tucty proteinových součástí, které zastávají specializované úkoly nutné k tomu, aby celý složitý systém fungoval. Ony tucty proteinů jsou kódovány tucty genů v bakteriální buňce. Geny jsou seskupeny do čtrnácti svazků zvaných „operony“. Vedle každého operonu jsou v DNA kontrolní signály. Samotné kontrolní signály spadají do tří kategorií, které budeme nazývat třída 1, třída 2 a třída 3. Geny pro proteiny, které musí být vytvořeny jako první ve stavebním procesu, mají kontrolní signály třídy 1, geny, které následují jako druhé, mají signály třídy 2 a tak dále.
Operon = seskupení genů, které u bakterií vytvářejí funkční jednotku se společnou regulací (pozn. překl.)
Po většinu času nestaví bakteriální buňka bičík, protože ho už má. Avšak po buněčném dělení musí nová buňka začít se stavebním programem. Na počátku „vycítí“ mechanicky kontrolní oblasti pro geny třídy 1, že přišel čas, a zapnou geny třídy 1. Ve třídě 1 existuje pouze jeden operon, který obsahuje jen dva geny. Geny kódují dva řetězce proteinů, které se podobně jako řetězce alfa a beta u hemoglobinu nalepují na sebe a vytvářejí jediný funkční proteinový komplex. Onen protein není ani součástí bičíku ani součástí stavebního aparátu. Spíš se podobá dílovedoucímu celého projektu, který musí říci ostatním dělníkům, co mají dělat. Nazvěme ho „šéfovským“ proteinem.
Šéfovský protein se váže specificky na kontrolní oblasti DNA sedmi operonů třídy 2 a mechanicky je zapíná. Geny třídy 2 kódují proteiny, které tvoří základ bičíku (plus nějaké ty pomocné proteiny), právě tak, jak byste očekávali při stavbě vzhůru nohama. Jeden gen třídy 2 není však součástí základu. Je to další kontrolní protein. Nazvěme ho „podšéfovským“ proteinem. Podšéfovský protein se váže na kontrolní oblast DNA genů třídy 3, které zahrnují proteiny, jež tvoří vnější části bičíku. A tak každá třída genů obsahuje gen pro protein, který zapne třídu další.
To ale není všechno. Tahle část je tak důmyslná, že kontrolní systém je mnohem jemněji vyladěn než pouhé stupňovité kontrolní proteiny. Dlouhá léta badatelé věděli, že kdyby byly geny pro kteroukoli z dvacítky proteinových částí ve třídě 2 – ty, které vytvořily základ bičíku – v laborce experimentálně narušeny, zůstaly by geny pro vnější části bičíku vypnuty. Ale jak by mohly tak početné geny všechny kontrolovat pozdější stavbu?
Třída 3 obsahuje gen pro protein, který se úzce váže na podšéfovský protein a vypíná ho. Nazvěme ho „kontrolním“ proteinem. Proč však zapínat podšéfa jen proto, abychom ho ihned deaktivovali kontrolním proteinem? V pozdější fázi stavebního projektu se bičík chytrým manévrem kontrolního proteinu zbavuje. Bičík je nejen elegantním přívěsným motorem, nýbrž obsahuje též ve svém základu složitou pumpu, která aktivně vytlačuje části proteinů třídy 3, aby se vytvořil vnější díl struktury.
V tom spočívá onen elegantní fígl. Když je pumpa v základu bičíku hotová a běží, jedním z prvních proteinů, které vytlačí, je protein kontrolní. Vyloučení kontrolního proteinu umožňuje proteinu podšéfovskému navázat se na kontrolní oblasti operonů třídy 3 a zapnout geny pro vnější díl bičíku. A tak je dokončení první části bičíku přímo propojeno se zapnutím genů k tvorbě částí finálních.
„ZÁVRATNÁ SLOŽITOST“
Teprve v posledních několika letech vyvinula skupina izraelských vědců chytré nové laboratorní techniky, které analyzují do ještě jemnějších podrobností kontrolu uplatňovanou kontrolními prvky DNA při stavbě bičíku. Tím, že průběžně přiřazovali kontrolní prvky ke genům pro proteiny, které mohou být lokalizovány podle své fluorescence, prokázali tito vědci, že včetně tříd 2 a 3 zapínají kontrolní prvky geny proto, že jsou třeba ke stavbě. V rámci třídy 2 jsou geny nutné pro spodek základny zapínány před geny pro vršek základny a v rámci třídy 3 jsou geny pro podklad vršku aktivovány před geny pro vrchol vršku (16).
OBRÁZEK 5.3
Geny pro stavbu bakteriálního bičíku jsou aktivovány přesně načasovaným způsobem. Ony nutné pro stavbu základů molekulárního soustrojí jsou zapínány jako první, následovány postupně geny potřebnými pro vzdálenější oblasti. (Vyobrazení bičíku přetištěno s laskavým svolením Kyoto Encyclopedia of Genes and Genomes, Kanehisa, M., Goto, S., Hattori, M., Aoki-Kinoshita, K. F., Itoh, M., Kawashima, S., Katayama, T., Araki, M., a Hirakawa, M., 2006. Od genomiky k chemické genomice: nové trendy v KEGG. Nucleic Acids Res. 34:D354-57.)
Táž skupina vědců zkoumala také kontrolní prvky DNA u dalších buněčných systémů a objevila tam podobnou eleganci. Když studovali buněčné biochemické cesty pro tvorbu aminokyselin, objevili to, co nazýváme organizací „právě včas“, kdy je protein vytvářen tak bezprostředně před upotřebením, jak to jen jde:
„Matematická analýza naznačuje, že tenhle transkripční program „právě včas“ je optimální pod tlakem nutnosti dosáhnout rychle cíle produkce s minimální celkovou produkcí enzymů. Naše poznatky napovídají, že sítě metabolické regulace jsou navrženy tak, aby umožňovaly přesné načasování promotoru i aktivačních programů, které můžeme pochopit s použitím technických zásad fungování energovodů“ (17).
Promotor = část DNA v blízkosti genu (RNA sekvence bází, které mají specifické vazební body pro RNA-polymerázu), která se podílí na regulaci jeho exprese (pozn. překl.).
Co chce říci všechno tohle obsáhlé líčení? V kostce, čím blíže buňku zkoumáme, tím elegantnější a promyšlenější se nám jeví. Složité, výkonné struktury jako je řasinka a bičík stojí pouze na počátku. Aby se vytvořily, vyžaduje to složitý stavební aparát i kontrolní programy. Bez oněch podpůrných systémů by konečné struktury nevznikly. Bakteriální bičík obsahuje několik tuctů proteinových součástek. Řasinka, která zatím odolává poznání svého kontrolního programu DNA, jich má několik set. Je tedy jenom nasnadě se domnívat, že kontrola její stavby bude muset být mnohem složitější než je tomu u bičíku.
Kontrola stavebních projektů a další činnosti v buňce se vědcům studují špatně, protože „kontrola“ není fyzikálním objektem jako je tomu u konkrétní molekuly, kterou můžeme izolovat ve zkumavce. Jde zde o načasování a uspořádání. Důsledkem tohoto stavu je fakt, že ještě dnes v jednadvacátém století – více než padesát let poté, co byla Watsonem a Crickem objevena dvojšroubovice DNA a několik desetiletí poté, co jsme poznali první rentgenové krystalové struktury proteinů – odhaluje stále věda zásadní nové mechanizmy, které kontrolují fungování buňky.
Watson, James D. (nar. 1928): americký biofyzik, který spolu s britským biofyzikem F. H. C. Crickem (nar. 1916) pomocí rtg difrakce popsal molekulární struktury DNA a způsob duplikace molekul DNA, genů a chromozomů (Nobelova cena 1962) (pozn. překl.).
Nedávno – nějakých pětašedesát let poté, co George Beadle a Edward Tatum navrhli klasickou definici genu jako úseku DNA, který kóduje enzym – vyšel v časopisu Nature zajímavý článek s pozoruhodným názvem „Co je to gen?“ Jeho hlavní myšlenkou bylo konstatování, že kontrolní systémy, které určují kdy, kde a kolik určitého proteinu se vytvoří, se stávají tak složitými a jejich rozložení v DNA má tak široký záběr, že samotný pojem „genu“ jako konkrétní oblasti DNA už není přiměřený. Autoři zde žasnou nad tím, že „Obrázek, který tyhle studie poskytují, se vyznačuje závratnou složitostí“. (18).
Beadle, George Wells (1903-1989): americký biolog. Objevil způsob, jakým geny řídí biochemické děje v buňkách organizmů. Spoluautor teorie nazývané „jeden gen = jeden enzym. Spoluzakladatel biochemické genetiky. Své objevy uskutečnil na plísni rodu Neurospora, druhu Neurospora crassa; tento druh se stal jedním z modelových organizmů používaných pro genetická studia. V roce 1958 mu byla udělena Nobelova cena (společně s E. L. Tatumem aj. Lederbergem). (pozn. překl.)
Tatum, Edward Lawrie (1909-1975), americký genetik; prof. Yaleské univ., pak Stanfordovy univ. v Kalifornii. (pozn. překl.)
VYMEZOVÁNÍ HRANICE
Kde je rozumné stanovit hranici evoluce? V téhle kapitole a v té předchozí jsem zamýšlel tuhle otázku precizovat – poukázat na příklady toho, co podle mého názoru jednoznačně lze a co nelze vysvětlit náhodnými mutacemi a přirozeným výběrem. Kdesi mezi oněmi dvěma extrémy pak leží ona hranice.
Na jedné straně jsou zde naše nejlepší příklady ze zákopové války lidstva s parazity – příklady toho, co náhodné mutace a přírodní výběr zvládnou, jak víme. Víme, že omezené změny jednotlivých genů mohou někdy vyvolat významný přínosný účinek. Klasickým příkladem uváděným prakticky ve všech učebnicích biologie je případ srpkovitého hemoglobinu, kdy změna jediné aminokyseliny umožňuje odolnost vůči malárii, což zachrání mnoho dětí od předčasné smrti. Další příklady odpovídají změně jednoho profilu, jako třeba HbC a HbE, odolnost vůči warfarinu a DDT a tak dále. Náhodné mutace stojí též za dlouhou řadou narušených genů, které mohou být přínosem za neblahých okolností: talasémie, nedostatek G6PD, vypuštění CCR5 a tak dále.
Ve vzácnějších případech se může několik mutací postupně pospojovat a zlepšit tak vyhlídky organizmu na přežití. Příkladem je přerušení regulačních kontrol fetálního hemoglobinu, které pomáhá zmírňovat srpkovitou anemii. Velmi, velmi vzácně dochází k několika mutacím u aminokyselin zároveň, což účinkuje blahodárně, jako třeba při odolnosti vůči chlorochinu s mutantem PfCRT. Změna více aminokyselin nějakého proteinu současně vyžaduje populaci čítající ohromné množství organizmů. V případě malarického parazita takové množství existuje. Pokud jde o tvory větší, tam k dispozici není.
Na druhé straně jsou příklady toho, co náhodné mutace a přírodní výběr jednoznačně nezvládnou. V této kapitole jsem probral několik případů – IFT a kontrolu stavby bakteriálního bičíku – z rejstříku úžasně složitých, promyšlených systémů, jichž je buňka plná. Takové systémy netvoří pouhá jedna či dvě změny aminokyselin v náhodných proteinech přítomných v systémech, které jsou určeny pro jiné úkoly – tvoří je tucty různých proteinů specializovaných na svou práci. Nevznikly narušením genů; vyžadovaly koordinovanou výstavbu mnoha genů zcela nových. Řasinky a bičíky jsou nejen úžasně složitými autonomními systémy, nýbrž mají i složité systémy ovlivňující jejich výstavbu i genetické kontrolní systémy tuto výstavbu koordinující, jejichž promyšlenost začíná věda teprve nyní oceňovat.
Strukturální elegance systémů jako jsou řasinky, funkční promyšlenost způsobů jejich výstavby a naprostý nedostatek seriózních darwinovských vysvětlení – to vše vytrvale odkazuje k témuž závěru: Jsou daleko za hranicí evoluce. Takové promyšlené, složité buněčné systémy nevznikly náhodnými mutacemi a přírodním výběrem tak jako přehrada Hoover Dam nebyla postavena z chaotické směsi větviček, listí a usazenin.










| Příloha | Velikost |
|---|---|
| Nepřekonatelná hranice evoluce-5 kapitol bez odkazů.doc | 6.99 MB |
| Nepřekonatelná hranice evoluce-Jen odkazy k 5 kapitolám.doc | 3.98 MB |

