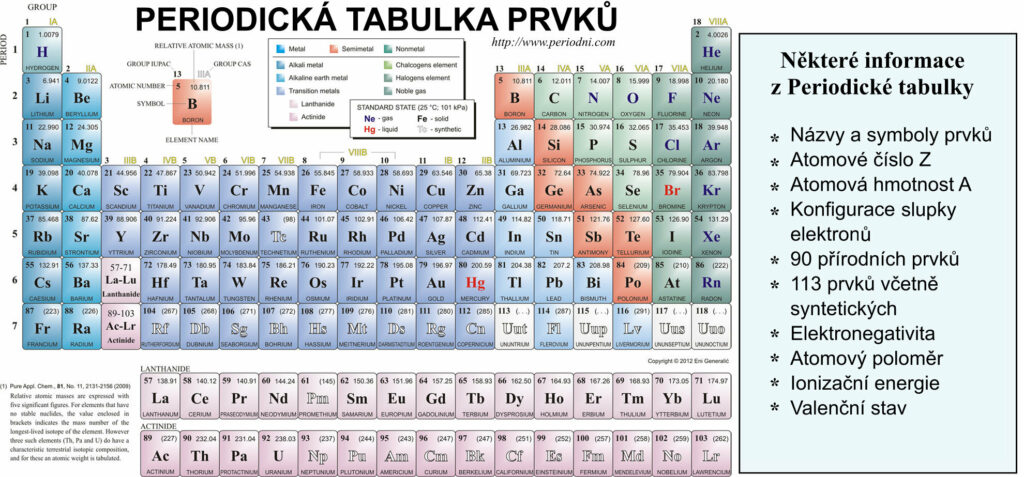
Periodická tabulka chemických prvků
Z creation.com přeložil Pavel Akrman – 08/2024. Translation granted by Creation.com – přeloženo s povolením od Creation.com (úvodní obrázek: Science & Faith).

Dmitrij Mendělejev (1834-1907)
Vpravo: Dmitrij Mendělejev (1834-1907): „Ten nápad jsem nejprve uviděl ve svém snu.“
Krásu a organizaci Božího stvoření lze vidět všude kolem nás v makroskopickém světě. To, co pozorujeme z rostlinného života, hvězd, zvířat, skal, vzduchu a vody – a prakticky všechno – se skládá z 90 přirozeně se vyskytujících stavebních bloků, které jsou známé jako atomy. Řád začíná atomy a subatomárními částicemi, které je tvoří. Toto uspořádání není náhodné či chaotické seskupení částic, které se náhodně nebo spontánně organizují bez inteligentní příčiny. Podíváme-li se na charakter atomů, je jasně vidět jejich stvoření. Když Bůh tvořil, uvedl do vesmíru řád až do nejmenších věcí, protože Bůh není původcem zmatku (1 Korintským 14:33).
Dmitrij Mendělejev (1834-1907), ruský chemik, vyvinul formální uspořádání prvků v roce 1869 poté, co měl sen.1 „Ve snu jsem viděl tabulku, kde všechny prvky zapadly na místo, jak bylo požadováno. Po probuzení jsem si to okamžitě zaznamenal na papír – jen na jednom místě se později zdálo, že je nutné to opravit.“2 Mendělejevova tabulka je pozoruhodná, protože vykazuje nejpřesnější hodnoty atomové hmotnosti, což umožňuje rozpoznat trendy v celé řadě prvků. Mendělejev viděl, že tabulka se 65 známými prvky je těžištěm celé chemie, ale že je neúplná. Byla tam místa, kde by měly být umístěny prvky, ale nikdo je v té době neobjevil. Poté, co Mendělejev ve své studii uviděl v periodické tabulce mezeru mezi křemíkem a cínem, předpověděl objev chybějícího prvku, který on nazval „eka-křemík“. Když byl nový prvek objeven, dostal název „germanium“ – jeho vlastnosti pro atomovou hmotnost, hustotu a bod tání těsně odpovídaly Mendělejevovým předpovědím „eka-křemíku“.
Pozn. překl.: Předpona „eka“ znamená v sanskrtu „první nejbližší“. Proto se při tvorbě předběžného názvu vycházelo z nejbližšího prvku ve skupině.
Periodická tabulka
Tabulka, jako nejsilnější a možná nejméně srozumitelný nástroj vědy, jasně vykazuje řád a pravidelnost. Organizovaná struktura atomů vede k předvídatelným vlastnostem a chemickému chování, takže lze předpovědět, jak se budou atomy vázat nebo reagovat s jinými atomy při vzniku složitých víceatomových chemických sloučenin, jako je DNA. Atomy jsou periodické kvůli způsobu, jakým jsou subatomární částice uspořádány a přidávány do každého atomu; proto mohou být umístěny v tabulce systematicky. Tuto tabulku používají ve své práci chemici, a všichni tak mohou poznávat tu strukturální krásu od Boha Stvořitele.
Periodická tabulka nám říká mnoho věcí. Nejvýraznější je typ atomu, který je zřetelně označen dvoupísmenným symbolem, dále jeho etymologie – především ze zkratek latinských a řeckých jmen nebo objevitelů prvku, a atomové číslo prvku Z,3 které se rovná počtu protonů v jádře. Atomová hmotnost je celková hmotnost protonů plus neutronů nalezených v jádře.
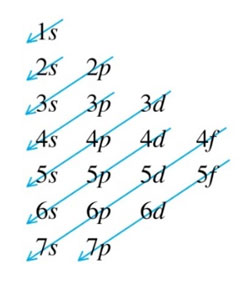
Obrázek 1.
Pochopení organizace periodické tabulky se může zdát jako těžký úkol, ale základního porozumění lze dosáhnout po vysvětlení atomové struktury. Atom je nejmenší jednotkou hmoty, která má všechny chemické vlastnosti dané látky. Tento materiál, jinak známý jako prvek, nelze chemicky rozložit nebo změnit na jinou látku. Struktura atomu se skládá z protonů a neutronů v jádře, a elektronů, pohybujících se kolem jádra v určitých energetických úrovních, které nazýváme slupky.
Slupky, někdy zvané jako hlavní energetické úrovně, jsou označeny K, L, M nebo 1, 2, 3. Ty se dále dělí na orbitální typy s, p, d a f 4 (někdy nazývané podslupky), z nichž každá je schopna pojmout maximálně 2 elektrony.1. První, nejniternější slupka s, pojme až dva elektrony, druhá slupka může mít až osm elektronů (2s2 + 2p6), třetí slupka může držet až 18 elektronů (3s2 + 3p6 + 3d10). Podle obecného vzorce platí, že n-tá slupka může v zásadě udržet až 2n2 elektronů. Jak se atomové číslo prvku zvětšuje, elektrony se přidávají systematicky a specifickým a uspořádaným způsobem k orbitalům, když se k jádru přidávají protony – což se nazývá Aufbau princip. V základním stavu atomu tedy elektrony obsazují jednotlivé slupky a podslupky tak, aby měly co nejnižší energii. Fakt, že elektrony přednostně obsazují energeticky nejnižší orbitaly, je základem pro určení elektronové konfigurace prvků a struktury periodické tabulky. Obrázek 1 je jednoduchý diagram, který pomáhá určit pořadí plnění slupek. Z tohoto diagramu lze určit elektronovou konfiguraci libovolného atomu. Orbitální typy mají svůj vlastní charakteristický tvar, jak je znázorněno na obrázku 2.
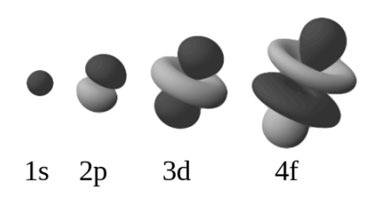
Obrázek 2.
V periodické tabulce začíná horizontální perioda, reprezentovaná řádky 1-7, vodíkem (H) a lithiem (Li) a udává počet elektronových slupek v atomu. H je nejjednodušší atom s jedním elektronem a jedním protonem. Li má tři elektrony a jádro se třemi protony a čtyřmi neutrony. Primárním a klíčovým faktorem vlastností chemického prvku je tzv. valenční slupka neboli ty nejvzdálenější elektrony.
O atomech na levé straně tabulky lze říci, že mají volné držení svých elektronů, zatímco prvky na pravé straně (s výjimkou vzácných plynů5) snadno přitahují elektrony, čímž volně vytvářejí vazby s jinými prvky. Jsou-li vnější elektrony sdíleny s jiným atomem, nastává chemická reakce neboli vazba. Vytváření těžších atomů z vodíku probíhá přidáním kladně nabitého protonu k jádru a neutrálně nabitého neutronu, jak je požadováno pro hmotnostní číslo. Každý proton je spárován s přidaným záporně nabitým elektronem. Toto systematické přidávání udržuje neutrální atomový náboj, čímž vzniká skupina prvků s podobnými vlastnostmi, jako jsou například halogeny, počínaje fluorem.
Skupina neboli rodina reprezentovaná v tabulce každým ze svislých sloupců 1-18 označuje počet elektronů v nejvzdálenější slupce. Přesuneme-li se do skupiny 1, jsou pod vodíkem alkalické kovy – lithium, sodík atd. – které mají z hlediska chemické reaktivity podobné chemické vlastnosti. Jde o měkké kovy, snadno reagující s vodou, protože všechny mají jeden volně držený elektron, který lze snadno ztratit. Druhá skupina, známá jako prvky alkalických zemin, začíná beryliem, má 2 elektrony, které se snadno ztratí. Totéž lze říci i o dalších prvcích ve zbývajících sloupcích tabulky. Počet elektronů a protonů je v tabulce po sobě jdoucí, počínaje Z = 1 pro vodík (H) a konče Z = 116 Livermorium (Lv), nejtěžším syntetickým prvkem6 v pravém dolním rohu. Mohou být objeveny i těžší syntetické prvky, až do Z = 118.
Postupujeme-li v tabulce od nejlehčích prvků na levé straně k nejtěžším atomům na její pravé straně, některé vlastnosti prvků se blíží hodnotám prvků uvedených nad nimi. Tyto vlastnosti se vyskytují ve skupině v pravidelných intervalech 2, 8, 18 a 32. Například helium v 18. skupině prvků je svým chemickým chováním podobné neonu, argonu, kryptonu, xenonu a radonu pod ním. Jsou známé jako vzácné plyny, jsou inertní neboli nereagující, i když krypton a xenon tvoří několik sloučenin. Chemická rodina zvaná halogeny, tedy skupina 17, složená z prvků fluor (Z = 9), chlor (Z = 17), brom (Z = 35), jod (Z = 53) a astat (Z = 85) je extrémně reaktivní a snadno se spojuje s prvky skupin 1 a 2 přijetím elektronů.
Závěr
Boží uspořádání vesmíru lze vidět i v té nejmenší jednotce hmoty, atomu. Jsou to základní stavební kameny všech materiálů. Atomy ve svém složení nejsou chaotické, ale jsou záměrně uspořádány tak, že elektrony jsou přidávány k orbitalům, a protony a neutrony v jádře. Odtud plynou jejich periodické a předvídatelné vlastnosti, které stvořil Bůh pořádku.
Odkazy a poznámky
- Garret, A. B., Lippincott, W.T., Chemistry A Study of Matter, Blaisdell Publishing Co., Watham, MA, 1968.
- Sharpe, M.E., The Soviet Review Translations, Summer 1967, Vol. VIII, No. 2, p. 38, digitalcollections.library.cmu.edu.
- Označení Z je z německého Zahl, znamenající číslo.
- Tato písmena původně pocházela z popisu čar v atomovém spektru: ostré, hlavní, difúzní a základní.
- Všechny vzácné plyny mají zaplněné orbitaly a jsou ve stabilní konfiguraci.
- V chemii je syntetický prvek ten, který se přirozeně nevyskytuje, ale je vytvořen uměle.